细胞外囊泡与颗粒
细胞外囊泡类型与生物发生
根据起源和生物发生机制,不同类型的 EVs 已被分类(图 2)。
已知至少存在三种主要的生物发生模式:
- 凋亡 EVs(称为凋亡小体和凋亡囊泡)由凋亡细胞的碎片化产生;
- 胞外体(ectosomes)通过质膜直接向外出芽形成;
- 外泌体(exosomes)则通过内体区室的向内出芽形成,并最终与质膜融合释放。
鉴于 EV 类型的多样性以及许多情况下其生物发生机制的不确定性,国际细胞外囊泡协会(MISEV)采取了一种实用的分类方法,将 EVs 分为 “大 EVs”(>200 nm)和 “小 EVs”(<200 nm)然而,提醒研究界关注不同类型的 EVs 和非囊泡细胞外纳米颗粒(NVEPs)以及这些细胞外颗粒的最新研究进展,不仅有用且十分及时。
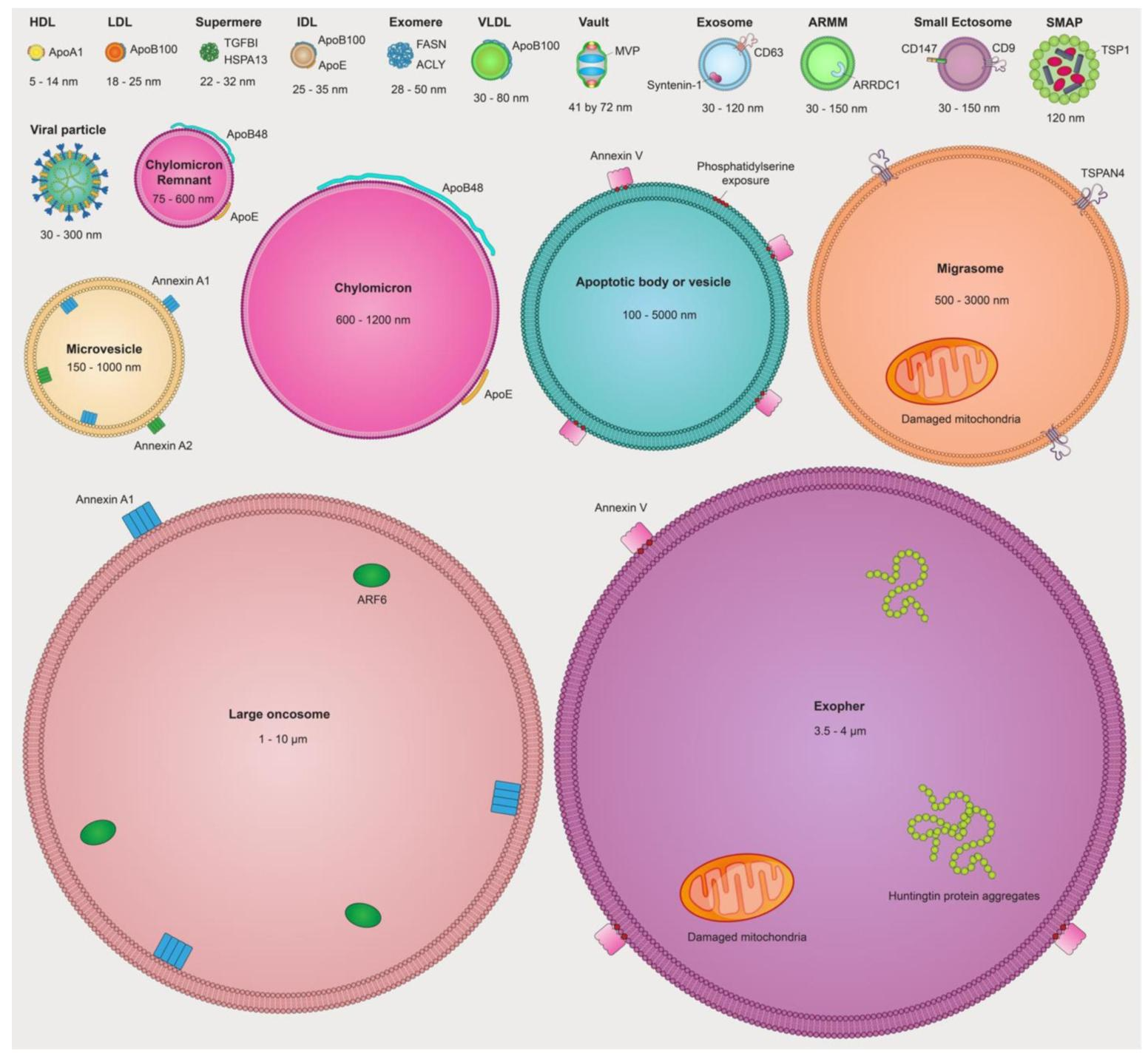
外泌体
外泌体的形成始于内体,晚期内体的限制膜向内出芽,在多泡内体(multivesicular endosome, MVE) 内生成腔内囊泡(intraluminal vesicles, ILVs)。这种向内出芽的过程导致内吞的跨膜蛋白重新定向 —— 其胞外结构域朝外(具备信号传导能力),而胞内尾部则朝向 ILV 内部及其包裹的货物。当 MVE 与质膜融合时,ILVs 作为 30-150 nm 的外泌体释放到细胞外空间 。内体分选转运复合体(endosomal sorting complex required for transport, ESCRT) 机制在 MVE 中将蛋白质分选到 ILVs 的过程中至关重要,因此是外泌体形成的关键。然而,ESCRT 及其辅助蛋白(如 TSG101、ALIX 和 VPS4)也参与质膜的向外出芽过程,包括囊泡释放和病毒释放 。
另一种参与外泌体形成和蛋白质装载的蛋白 Syntenin-1 ,在小 EV 样本中高度富集,但在大 EV 样本中也可能存在。同样,尽管 CD63、CD81 和 CD9 等四跨膜蛋白(tetraspanin, TSPAN)在外泌体中显著富集 ,并长期被用作外泌体的标记蛋白,但越来越多的研究表明,含 TSPAN 的小 EV 可能直接从质膜出芽,根据其生物发生机制应归类为胞外体 / 微泡(ectosomes/microvesicles)。