细胞信号转导
细胞信号转导
第一节细胞通信与信号转导
一、细胞通信
细胞通信可概括为三种类型:
- (1) 信号细胞通过分泌==胞外化学信号==进行细胞间通信,这是多细胞生物普遍采用的通信方式;
- (2) ==细胞间接触==依赖性通信(contact-dependentsignaling),细胞直接接触,通过信号细胞跨膜信号分子(配体)与相邻靶细胞表面受体相互作用;
- (3) 动物相邻细胞间形成==间隙连接(gapjunction)、植物细胞间通过胞间连丝(plasmodesma)==使细胞间相互沟通,通过交换小分子来实现代谢偶联或电偶联,从而实现功能调控。
信号细胞分泌胞外信号,按其对靶细胞发挥效应的空间距离和作用方式,又可分为:
- (1) 内分泌(endocrine),在动物中由内分泌细胞分泌胞外信号分子(如激素),通过血液或其他细胞外液运送到体内各相应组织,作用于靶细胞而发挥作用(图11-1A)。
- (2)旁分泌(paracrine),细胞通过分泌局部化学介质到细胞外液中,经过局部扩散作用于邻近靶细胞而发挥作用(图11-1B),在多细胞生物中调节发育的许多生长因子往往是通过短距离而起作用的;旁分泌方式对创伤或感染组织刺激细胞增殖以恢复功能也具有重要意义。
- (3)自分泌(autocrine),释放信号分子的细胞也是发挥效应的靶细胞,即对自身分泌的信号分子产生反应(图11-1C)。自分泌信号常存在于病理条件下,如肿瘤细胞合成并释放生长因子刺激细胞自身,导致肿瘤细胞的增殖;此外,通过分泌信息素(pheromone)传递信息也属于通过化学信号进行细胞间通信,作用于同类的其他个体。
- (4)突触信号传递(synapticsignaling),通过化学突触传递神经信号(图11-1D),从作用范围来讲,也当属短距离局部作用,当神经细胞接受刺激后,神经信号以动作电位的形式沿轴突快速(
细胞间接触依赖性通信,
- 细胞直接接触而无需信号分子的释放,通过信号细胞质膜上的信号分子与靶细胞质膜上的受体分子相互作用来介导细胞间的通信(图11-1E)。这种通信方式包括细胞-细胞黏着、细胞-基质黏着等。
- 在胚胎发育过程中对组织内相邻细胞的分化命运具有决定性影响。在胚胎发育过程中,部分胚胎上皮细胞层将发育成神经组织。最初相邻的上皮细胞是彼此相同的,但在发育过程中,某些单个上皮细胞通过独立分化成为神经细胞,而与其相邻的周边细胞则受到抑制保持非神经细胞状态。这是因为预分化形成神经细胞的细胞通过膜结合的抑制性信号分子(称为Delta)与其相接触的周边细胞的膜受体(Notch,见Notch信号通路)相互作用,阻止它们也分化为神经细胞。控制这一过程的信号是通过细胞间接触而传递的。这类膜表面的信号分子与受体基本类似,它们所介导的信号转导机制也基本相同。在接触依赖性通信缺陷的突变体中,有些细胞类型(如神经细胞)会过量发生。
二、细胞的信号分子与受体
(一)细胞的信号分子
信号分子(signalmolecule)是细胞的信息载体,种类繁多,包括化学信号诸如各类激素、局部介质(localmediator)和神经递质(neurotransmitter)等,以及物理信号诸如声、光、电和温度变化等。各种化学信号根据其性质通常可分为四类:
- (1)气体性信号分子(gaseoussignalmolecule),包括NO、CO,可以自由扩散,进入细胞直接激活效应酶(鸟苷酸环化酶)产生第二信使(cGMP),参与体内众多的生理过程,影响细胞行为。
- (2)疏水性信号分子,主要是留类激素和甲状腺素,是血液中长效信号(longlastingsignal),这类亲脂性分子小、疏水性强,可穿过细胞质膜进入细胞,与细胞内核受体(nuclearreceptor)结合形成激素一受体复合体,调节基因表达。
- (3)亲水性信号分子,包括神经递质、局部介质和大多数蛋白质类激素,它们不能透过靶细胞质膜,只能通过与靶细胞表面受体结合,经信号转换机制,在细胞内产生第二信使或激活蛋白激酶或蛋白磷酸酶的活性,引起细胞的应答反应。
- (4)膜结合信号分子,表达在细胞质膜上的信号分子,通过与靶细胞质膜上的受体分子相互作用,引起细胞应答。
表11-1列出了一些激素、局部介质、神经递质和接触依赖性信号分子(膜结合信号分子)。
| 信号分子 | 合成/分泌位点 | 化学性质 | 生理功能 |
| 激素: | |||
| 肾上腺素 | 肾上腺 | 酪氨酸的衍生物 | 升高血压、加快心律和增加代谢 |
| 皮质醇 | 肾上腺 | 类固醇(胆固醇衍生物) | 影响多数组织中蛋白质、糖类和脂质代谢 |
| 雌二醇 | 卵巢 | 类固醇(胆固醇衍生物) | 诱导和维持雌性第二性征 |
| 胰高血糖素 | 胰岛α细胞 | 肽 | 刺激葡萄糖合成、糖原降解和脂肪分解(如肝细胞和脂 肪细胞) |
| 胰岛素 | 胰岛β细胞 | 蛋白质 | 刺激肝细胞葡萄糖摄取、蛋白质合成和脂质合成 |
| 睾丸酮 | 睾丸 | 类固醇(胆固醇衍生物) | 诱导和维持雄性第二性征 |
| 甲状腺素 | 甲状腺 | 酪氨酸的衍生物 | 刺激多种细胞的代谢 |
| 局部介质: | |||
| 表皮生长因子(EGF) | 多种细胞 | 蛋白质 | 刺激上皮细胞等多种细胞的增殖 |
| 血小板衍生生长因子 (PDEF) | 多种细胞(包括血小板) | 蛋白质 | 刺激多种细胞的增殖 |
| 神经生长因子(NGF) | 各种神经支配的组织 | 蛋白质 | 促进某类神经细胞的存活:促进神经细胞轴突的生长 |
| 组胺 | 肥大细胞 | 组氨酸衍生物 | 扩张血管、增加渗透,有助发炎 |
| 一氧化氨(NO) | 神经细胞、血管内皮细胞 | 可溶性气体 | 引起平滑肌细胞松弛:调节神经细胞活性 |
| 神经递质: | |||
| 乙酰胆碱 | 神经末梢 | 胆碱衍生物 | 在许多神经-肌肉突触和中枢神经系统中存在的兴奋 |
| Y-氨基丁酸(GABA)神经末梢 | 谷氨酸衍生物 | 性神经递质 中枢神经系统中存在的抑制性神经递质 | |
| 接触依赖性信号: | |||
| Delta | 预定神经细胞、其他胚胎细胞 | 跨膜蛋白 | 抑制相邻细胞以与信号细胞相同的方式分化 |
(二)受体
受体(receptor)是一类能够识别和选择性结合某种配体(信号分子)的分子,已经鉴定的绝大多数受体都是蛋白质且多为糖蛋白,少数受体是糖脂(如霍乱毒素受体和百日咳毒素受体),有的受体是糖蛋白和糖脂组成的复合物(如促甲状腺素受体)。
根据靶细胞上受体存在的部位,可将受体区分为细胞内受体(intracellular recepor)和细胞表面受体(cell-surface receptor)。
- 细胞内受体位于细胞质基质或核基质中,主要识别和结合小的脂溶性信号分子,如甾类激素、甲状腺素、维生素D和视黄酸(retinoicacid),以及细胞或病原微生物的代谢产物、结构分子或者核酸物质;
- 细胞表面受体主要识别和结合亲水性信号分子,包括分泌型信号分子(如神经递质、多肽类激素、生长因子)或膜结合型信号分子(细胞表面抗原、细胞表面黏着分子等)。
根据信号转导机制和受体蛋白类型的不同,==细胞表面受体==又分属三大家族(图11-2):
- (1)离子通道偶联受体(ionchannel-coupledreceptor),是指受体本身既有信号(配体)结合位点,又是离子通道,其跨膜信号转导无需中间步骤,又称配体门控通道(ligand-gatedchannel)或递质门控通道(transmitter-gated channel)。
- (2)G蛋白偶联受体(G-protein-coupledreceptor,GPCR),是细胞表面受体中最大的家族,普遍存在于各类真核细胞表面,根据其偶联效应蛋白的不同,介导不同的信号通路。
- (3)酶联受体(enzyme-linkedreceptor),一类是受体胞内结构域具有潜在酶活性,另一类是受体本身不具酶活性,而是受体胞内段与酶相联系。
受体至少有结合域和功能域 不管哪种类型的受体,一般至少有两个功能域,结合配体的功能域及产生效应的功能域,分别具有结合特异性和效应特异性。细胞信号转导始于胞外信号分子与靶细胞表面受体的结合,受体结合特异性配体后而被激活,通过信号转导途径将胞外信号转换为胞内信号,结果诱发两类基本的细胞应答反应:
- 一是改变细胞内特殊的酶类和其他蛋白质的活性或功能,进而影响细胞代谢功能或细胞运动等
- 二是通过修饰细胞内转录因子刺激或阻遇特异靶基因表达,从而改变细胞特异性蛋白的表达量。 一般而言,前一类应答反应比后一类反应发生得更快些。故前者称为快反应(短期反应),后者称为慢反应(长期反应)(图11-3)。
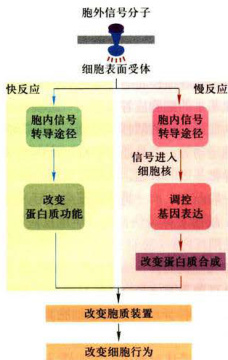
图11-3通过细胞表面受体转导胞外信号诱发两类基本细胞应答反应—快反应和慢反应
细胞对化学信号分子的应答方式各有不同
- 不同细胞对同种信号分子具有不同的受体,因不同的靶细胞以不同的方式应答于相同的化学信号:例如同为乙酰胆碱,作用于骨骼肌细胞引起收缩,作用于心肌细胞却降低收缩频率,作用于唾腺细胞则引起分泌。
- 另外也有不同的细胞具有相同的受体,当与同一种信号分子结合时,不同细胞对同一信号产生不同的反应,或同一细胞不同的受体应答于不同的胞外信号产生相同的效应;如肝细胞肾上腺素或胰高血糖素受体在结合各自配体被激活后,都能促进糖原降解而升高血糖。
- 绝大多数细胞同时具有多种类型的受体,应答多种不同的胞外信号从而启动不同的生物学效应,如存活、分裂、分化或死亡。 由此可见,靶细胞一是通过受体对信号结合的特异性,二是通过细胞本身固有的特征对外界信号产生反应。
(三)第二信使与分子开关
1.第二信使
第二信使(secondmessenger)是指在胞内产生的非蛋白类小分子,其浓度变化(增加或减少)应答胞外信号与细胞表面受体的结合,调节细胞内酶和非酶蛋白质的活性,从而在细胞信号转导途径中行使携带和放大信号的功能。
目前公认的第二信使包括cAMP、cGMP、Ca²、二酰甘油(1,2-diacylglycerol,DAG)和1,4,5-三磷酸肌醇(1,4,5-inositol trisphosphate,
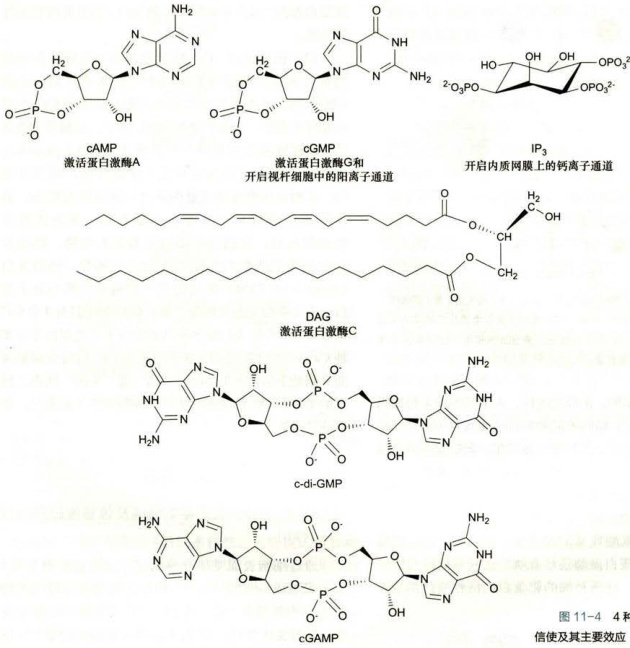
图11-44种常见的细胞内第二信使
2.分子开关(molecular switch)
(1)GTP酶分子开关调控蛋白构成细胞内GTP酶超家族,包括三聚体GTP结合蛋白和如Ras和类Ras蛋白的单体GTP结合蛋白。所有GTP酶开关蛋白都有两种状态:一是与GTP结合呈活化(开启)状态,进而改变特殊靶蛋白的活性;二是与GDP结合,处于失活(关闭)状态。GTP酶开关蛋白通过两种状态的转换控制下游靶蛋白的活性。
信号诱导的开关调控蛋白从失活态向活化态的转换,由鸟苷酸交换因子(guaninenucleotide-exchangefactor,GEF) 所介导,GEF引起GDP从开关蛋白释放,继而结合GTP并引发开关调控蛋白(G蛋白)构象改变使其活化;随着结合的GTP的水解形成GDP和Pi,开关调控蛋白又恢复成失活的关闭状态:GTP的水解速率又被GTP酶促进蛋白(GTPase-acceleratingprotein,GAP)和G蛋白信号调节子(regulator ofGprotein-signaling,RGS)所促进,被鸟苷酸解离抑制物(guaninenucleotidedissociation inhibitor,GDI)所抑制(图11-5)。
(2)蛋白激酶/蛋白磷酸酶另一类最普遍存在的分子开关机制是通过蛋白激酶使靶蛋白磷酸化,虽然这两种反应基本上是不可逆的,但综合蛋白激酶和蛋白磷酸酶的活性,蛋白质磷酸化和去磷酸化可为细胞提供一种“开关”机制,使各种靶蛋白处于“开启”或“关闭”的状态(图11-6)。
蛋白质磷酸化和去磷酸化可以改变蛋白质的电荷并改变蛋白质构象,从而导致该蛋白质活性的增强或降低,是细胞内普遍存在的一种调节机制,蛋白激酶和蛋白磷酸酶在几乎所有的信号通路中被普遍使用。在代谢调节、基因表达、周期调控中具有重要作用。在不同的细胞类型中,每种蛋白激酶在一套靶蛋白中磷酸化特殊的氨基酸残基,在动物细胞中有两种类型的蛋白激酶—一类是将磷酸基团加在酪氨酸残基的羟基上,称为==酪氨酸激酶,另一类是将磷酸基团加在靶蛋白丝氨酸或/和苏氨酸残基的羟基上,称为丝/苏氨酸激酶==;并且所有蛋白激酶还结合磷酸化残基周围的特异性氨基酸序列。这两种酶的靶蛋白的活性变化都是通过蛋白激酶/蛋白磷酸酶开关调节的,并且具有靶蛋白特异性。
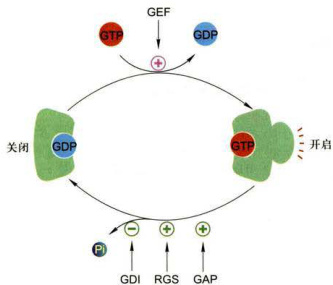
图11-5GTP酶开关调控蛋白活化(开)与失活(关)的转换通过结合的GTP的水解,GTP酶开关蛋白由活化态转换为失活态,该过程受GAP和RGS的促进,受GDI的抑制:GTP酶开关蛋白的再活化被GEF的促进。
(3)钙调蛋白
钙调蛋白(calmodulin,CaM) 是细胞质中普遍存在的小分子蛋白,有148个氨基酸残基,每个CaM分子具有4个
三、信号转导系统及其特性
(一)信号转导系统的基本组成及信号蛋白的相互作用
通过细胞表面受体介导的信号通路通常由下列5个步骤组成(图11-7):
- (1)受体特异性识别并结合胞外信号分子(配体),形成受体-配体复合物,导致受体激活。
- (2)由于受体构象改变,导致信号初级跨膜转导,靶细胞内产生第二信使或活化的信号蛋白。
- (3)通过胞内第二信使或蛋白复合物的装配,起始信号放大级联反应(signaling cascade)。
- (4)细胞应答反应。 如果是通过酶的逐级激活,其结果可能改变细胞代谢活性; 如果是通过表达基因调控蛋白,其结果可能影响发育; 如果是通过细胞骨架蛋白的修饰,其结果则改变细胞形状或运动。
- (5)由于受体脱敏(desensitization)或受体下调(down-regulation),终止或降低细胞反应。
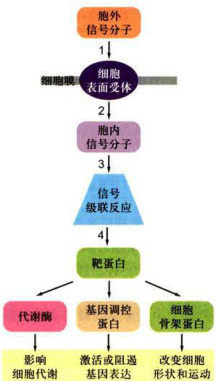
图11-7细胞表面受体介导的细胞信号转导系统的组成
细胞信号转导系统是由细胞内多种行使不同功能的信号蛋白所组成的信号传递链。受体通过细胞内信号蛋白的相互作用而传播信号,这必然涉及信号蛋白之间靠何种机制保障彼此的精确联系。细胞内信号蛋白的相互作用是靠蛋白质模式结合域(modularbindingdomain)所特异性介导的,多种模式结合域经多重相互作用极大地拓展了细胞内信号网络的多样性。这些模式结合域通常由
ShcA(C端具SH2结构域,N端具PTB结构域)、胰岛素受体底物(IRS)等:
1991年,进一步阐明了SH2结构域的基本功能,人类基因组大约编码115种SH2结构域,该蛋白质家族包括多种功能性成员:(1)酶,含有一或两个与催化序列相联系的SH2结构域,如蛋白激酶或蛋白磷酸酶结构域、磷脂酶C、RasGAP结构域、Rho家族GEF结构域;(2)癌蛋白和致病性互作(oncogenicproteinandpathogenicinteraction),如人慢性粒细胞白血病Bcr-Abl癌蛋白;(3)锚定蛋白(dockingprotein),如哺乳类
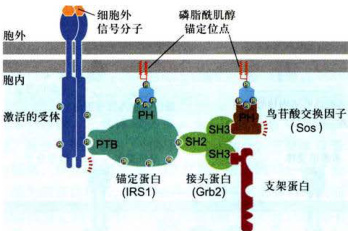
图11-8细胞内信号蛋白之间的相互作用是靠蛋白质模式结合域所特异性介导的示意图
图中具有SH2结构域的蛋白质具有相似的三维结构,每一成员可特异性结合围绕磷酸酪氨酸残基的氨基酸序列。IRS为胰岛素受体底物。
表11-2蛋白质模式结构域及其结合基序特异性
| 结构域 | 结合基序特征 | 举例 |
| SH2结构域 | 特异性结合磷酸酪氨酸残基(p-Tyr) | Src、Grb2、Shc、STAT |
| SH3结构域 | 结合富含脯氨酸序列(PXXP)和RXXK | Src、Nck |
| PTB结构域 | 结合NPXY基序 | Shc、IRS1 |
| PDZ结构域 | 识别膜蛋白C端4~5个氨基酸残基组成的短肽基序(通常最末端为 Val-COOH) | Dishevelled、FAP |
| WW结构域 | 结合富含脯氨酸基序(XPPXY) | Nedd4(E3泛素连接酶)、Smurf、Dystrophin |
| PH结构域 | 与肌醇磷脂结合,将蛋白质靶向质膜(PI(3,4)P、PI4,5)P、Pl(3,4,5)P) | Akt、Sos |
| FYVE结构域 | 与肌醇磷脂结合,将蛋白质靶向内体 | EEA1、SARA (PI3P) |
| LIM结构域 | 识别基于转角的蛋白质基序 | |
| 死亡结构域 | Fas |
(二)细胞内信号蛋白复合物的装配
细胞内信号蛋白复合物的形成是信号蛋白间相互作用的结果,在时空上增强细胞应答反应的速度、效率和反应的特异性。胞内信号蛋白复合物的装配可能有三种不同策略: (1)细胞表面受体和某些细胞内信号蛋白通过与大的支架蛋白结合预先形成细胞内信号复合物,当受体结合胞外信号被激活后,再依次激活细胞内信号蛋白并向下游传递(图11-9A)。 (2)依赖激活的细胞表面受体装配细胞内信号蛋白复合物,即表面受体结合胞外信号被激活后,受体胞内段多个氨基酸残基位点发生自磷酸化(autophosphorylation)作用,从而为细胞内不同的信号蛋白提供锚定位点,形成短暂的信号转导复合物分别介导下游事件(图11-9B)。 (3)受体结合胞外信号被激活后,在邻近质膜上形成修饰的肌醇磷脂分子,从而募集具有PH结构域的信号蛋白,装配形成信号复合物(图11-9C)。
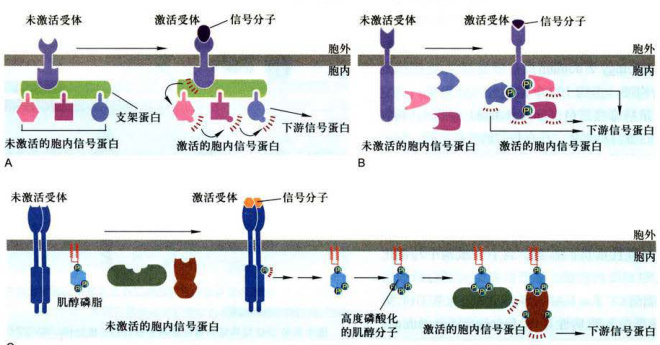
图11-9细胞内信号蛋白复合物装配的三种类型
(三)信号转导系统的主要特性
(1)==特异性(specificity)==细胞受体与胞外配体通过结构互补以非共价键结合,形成受体-配体复合物,简称具有“结合”特异性(bindingspecificity),受体因结合配体而改变构象被激活,介导特定的细胞反应,从而又表现出“效应器”特异性(effectorspecificity)。此外,受体与配体的结合具有饱和性和可逆性的特征。
(2)==放大效应(amplification)==胞外信号分子(通常称为第一信使)与细胞表面受体结合,导致细胞内某些低分子量细胞内信号分子(称为第二信使)浓度的增加或减少(如
(3)==网络化与反馈(feedback)调节机制==每一个细胞都处于错综复杂的信号环境之中,包括各种激素、生长因子、相邻细胞的表面蛋白,甚至危险信号等。这些信号分子相互作用,构成细胞信号的网络,激活不同的转录因子并调节不同的蛋白质表达,最终使细胞产生一种有条理的生物学反应。细胞信号网络中的不同信号通路之间的相互作用,主要通过一系列正反馈(positivefeedback)和负反馈(negativefeedback)来校正反应的速率和强度,把外界纷繁复杂的,甚至相互矛盾的信号进行归纳整理。细胞信号系统网络化及反馈调节是细胞生命活动的重要特征。
(4)==整合作用(integration)==多细胞生物的每个细胞都处于细胞“社会”环境之中,大量的信息以不同组合的方式调节细胞的行为。因此,细胞必须整合不同的信息,对细胞外信号分子的特异性组合作出程序性反应,甚至作出生死扶择,这样才能维持生命活动的有序性。
第二节 G蛋白偶联受体及其介导的信号转导
G蛋白偶联受体(GPCR)是细胞表面受体中最大的家族。统计表明,在人类基因组中有总数大约900个成员,其中有一半的基因被认为主要是编码嗅觉受体,尽管许多天然相关配体尚未被鉴定。现有超过
一、G蛋白偶联受体的结构与作用机制
G蛋白是三聚体GTP结合调节蛋白(trimericGTP-bindingregulatoryprotein)的简称,位于质膜内胞浆一侧,由α、β、三个亚基组成,
GPCR所介导的信号转导通路均具有如下共同元件: (1)所有GPCR均具有7次跨膜的
GPCR介导很多胞外信号的细胞应答,GPCR家族包括多种对蛋白或肽类激素、局部介质、神经递质和氨基酸或脂肪酸衍生物等配体识别与结合的受体,以及哺乳类嗅觉、味觉受体和视觉的光激活受体(视紫红质)。同时,不同的GPCR亚型也可以结合相同的激素,产生不同的的细胞效应。
(2)均偶联一个三聚体G蛋白,其功能是作为分子开关,以促成该蛋白在“活化”与“失活”两种状态之间转换。三聚体G蛋白
(3)均具有与质膜结合的效应器蛋白(effectorprotein),细胞表面通过G蛋白偶联的受体有多种效应器蛋白,包括离子通道蛋白、腺苷酸环化酶(adenylylcyclase)和磷脂酶C(phospholipaseC,PLC)等。不同的G蛋白被不同的GPCR激活,继而调控不同的效应器蛋白,分别产生不同的细胞效应。包括Gy激活
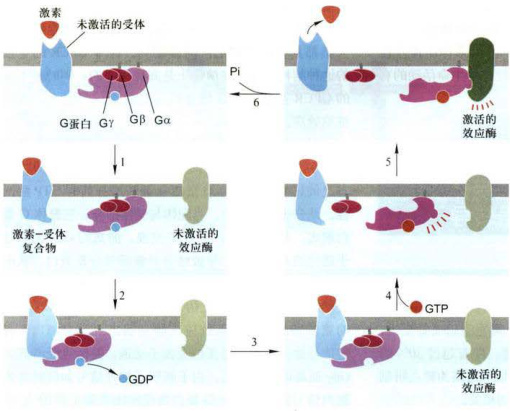
图11-11与G蛋白偶联受体相联系的效应蛋白的激活普遍机制
三聚体G蛋白解离活化的步骤如下:1.配体(激素)结合诱发受体构象改变:2.活化受体与Gα结合:3.活化的受体引发Gα构象改变,致使GDP与G蛋白解离;4.GTP与Gα结合,引发Gα与受体和Gβy解离:5.配体-受体复合物解离,Gα结合并激活效应蛋白:6.GTP水解成GDP,引发Gα与效应蛋白解离并重新与Gβy结合,恢复到三聚体G蛋白的静息状态。
表11-3哺乳类三聚体G蛋白的主要种类及其效应器
| Ga类型 | 结合的效应器 | 第二信使 | 受体举例 |
| Ga | 腺苷酸环化酶 | CAMP(升高) | β肾上腺受体,高血糖素受体,血中复合胺受体,后叶加压素受体 |
| Ga | 腺苷酸环化酶 | CAMP(降低) | α肾上腺受体 |
| K通道(Gβy激活效应器) | 膜电位改变 | M型乙酰胆碱受体 | |
| Gaa | 腺苷酸环化酶 | CAMP(升高) | 噢觉受体(鼻腔) |
| Gα | 磷脂酶C | IP,DAG(升高) | α肾上腺受体 |
| Gα | 磷脂酶C | IP,DAG(升高) | 乙酰胆碱受体(内皮细胞) |
| Ga | CGMP磷酸二脂酶 | CGMP(降低) | 视杆细胞中视紫红质(光受体) |
2-diacylglycerol,DAG)两种关键第二信使。
(4)在信号通路中均具有参与反馈调节或导致受体脱敏的蛋白。细胞对外界信号作出适度的反应既涉及信号的有效刺激和信号转导的启动,也依赖于信号的解除与细胞反应的终止,特别值得注意的是信号的解除与终止和信号的刺激与启动对于确保靶细胞对信号的适度反应来说同等重要。解除与终止信号的重要方式是在信号浓度过高或细胞长时间暴露某一种信号刺激的情况下,细胞会以不同的机制使受体脱敏,这种现象又称之为适应(adaptation),这是一种负反馈调控机制。
二、G蛋白偶联受体所介导的细胞信号通路
由GPCR所介导的细胞信号通路按其效应器蛋白的不同,可区分为三类:(1)激活离子通道的GPCR;
(一)激活离子通道的G蛋白偶联受体所介导的信号通路
当受体与配体结合被激活后,通过偶联G蛋白的分子开关作用,调控跨膜离子通道的开启与关闭,进而调节靶细胞的活性,这是最简单的细胞对信号做出的应答反应,也是神经冲动传导最基本的反应。如心肌细胞的M型乙酰胆碱受体和视杆细胞的光敏感受体,都属于这类调节离子通道的GPCR。
1.心肌细胞上M型乙酰胆碱受体激活G蛋白开启K通道
M型乙酰胆碱受体(muscarinic acetylcholinereceptor)在心肌细胞膜上与
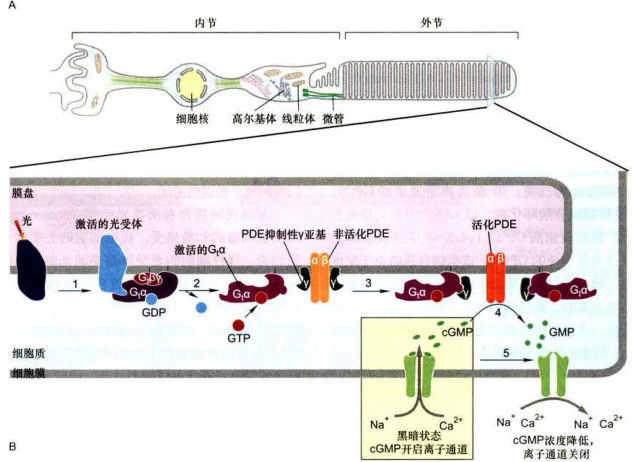
2.激活G蛋白偶联的光敏感受体诱发cGMP门控阳离子通道的关闭
人类视网膜含有两类光受体(photoreceptor),负责视觉刺激的初级感受。视锥细胞的光受体与色彩感受相关,视杆细胞的光受体接受弱光刺激。视紫红质(rhodopsin)是视杆细胞G蛋白偶联的光受体,定位在视杆细胞外段上千个扁平膜盘上,三聚体
如图11-13所示,在暗适应状态下的视杆细胞,高水平的第二信使cGMP保持cGMP门控非选择性阳离子通道的开放,光的吸收产生激活的视蛋白0(步骤1):活化的视蛋白与无活性的GDP-G,三聚体蛋白结合并引发GDP被GTP置换(步骤2):
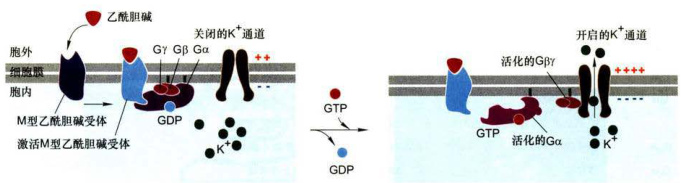
图11-12心肌细胞上M型乙酰胆碱受体的活化与效应器
这类受体通过三聚体G蛋白与
图11-13视杆细胞中G蛋白偶联的光受体(视紫红质)诱导的阳离子通道的关闭
A.视杆细胞结构模式图。B.G蛋白偶联的光受体介导的信号反应:在盘膜上活化的单分子视蛋白可以活化500个Gα分子,每个Gα分子又活化cGMP磷酸二脂酶(PDE),这是视觉系统中信号放大的初级阶段:然后光诱导的cGMP的减少导致非选择性阳离子通道的关闭,当光刺激停止,cGMP又逐渐恢复到原来水平。
(二)激活或抑制腺苷酸环化酶的G蛋白偶联受体
在绝大多数哺乳类细胞,GPCR介导的信号通路遵循如图11-12所示的普遍机制。在该信号通路中,Gα的首要效应酶是腺苷酸环化酶,通过腺苷酸环化酶活性的变化调节靶细胞内第二信使cAMP的水平,进而影响信号通路的下游事件。这是真核细胞应答激素反应的主要机制之一。
不同的受体-配体复合物或者刺激或者抑制腺苷酸环化酶活性,这类调控系统主要涉及5种蛋白质组分(图11-14):(1)刺激型激素的受体(receptorforsitimulatory hormone,R,),(2)抑制型激素的受体(receptorfor inhibitoryhormone,R,),(3)刺激型G蛋白(sitimulatoryG-protein,
R和R均为7次跨膜的GPCR,但与之结合的胞外配体不同。已知R有几十种,包括肾上腺素β型受体、胰高血糖素受体、后叶加压素受体、促黄体生成素受体、促卵泡激素受体、促甲状腺素受体、促肾上腺皮质激素受体和肠促胰酶激素受体等;R有肾上腺素
刺激型激素与相应受体R结合,偶联G(具刺激型α亚基,即 $\mathrm{G}_{s}\mathrm{\alpha}\mathrm{\alpha} $ ,刺激腺苷酸环化酶活性,提高靶细胞cAMP水平:抑制型激素与相应受体
腺苷酸环化酶是分子质量为
在多细胞动物各种以cAMP为第二信使的信号通路,主要是通过cAMP激活的蛋白激酶A(proteinkinaseA,PKA)所介导的。无活性的PKA是2个调节亚基(regulatorysubunit,R)和2个催化亚基(catalyticsubunit,C)组成的四聚体,在每个R亚基上有2个cAMP的结合位点,cAMP与R亚基结合是以协同方式(cooperativefashion)发生的,即第一个cAMP的结合会降低第二个cAMP结合的解离常数
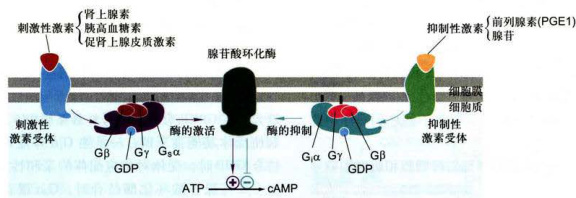
图11-14在脂肪细胞受激素诱导的腺苷酸环化酶的激活与抑制
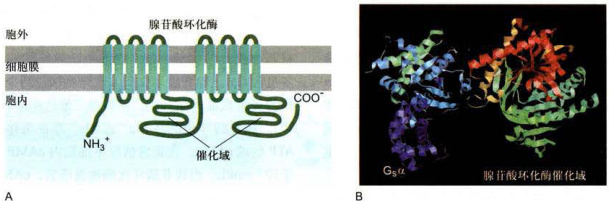
图11-15哺乳类腺苷酸环化酶的结构与该酶同Gα-GTP的相互作用
A.哺乳类腺苷酸环化酶的结构示意图:12次跨膜蛋白,含2个胞质侧催化结构域,2个膜整合结构域(每个含6个跨膜α螺旋)。B.包含牛Gα、狗的V型腺苷酸环化酶和鼠的I型腺苷酸环化酶催化结构域的重组三维结构(基于PDB数据库1CJT结构绘制)。
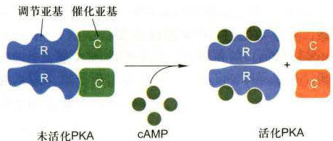
图11-16CAMP特异性地活化CAMP依赖的PKA,释放其催化亚基
PKA所介导的,但主要限于肝细胞和肌细胞,它们表达与糖原合成和降解有关的酶。在脂肪细胞,肾上腺素诱导的PKA的激活促进磷脂酶的磷酸化和活性。磷脂酶的作用是催化三酰甘油水解生成脂肪酸和甘油。释放的脂肪酸进入血液并被其他组织(如肾、心和肌肉)细胞用作能源。然而,卵巢细胞(ovariancell)GPCR在某些垂体激素刺激下导致PKA活化,转而促进两种类固醇激素(雌激素和孕酮)的合成,这对雌性性征发育至关重要。虽然PKA在不同类型的细胞作用于不同底物,但PKA总是磷酸化相同序列的基序X-Arg-(Arg/Lys)-X-(Ser/Thr)-Φ中(X代表任意氨基酸,
1.CAMP-PKA信号通路对肝细胞和肌细胞糖原代谢的调节
糖原代谢是由激素诱导的PKA的活化所调节的。正常人体维持血糖水平的稳态,需要神经系统、激素及组织器官的协同调节。肝和肌肉是调节血糖浓度的主要组织。脑组织活动对葡萄糖是高度依赖的,因而在应答胞外信号的反应中,cAMP水平会发生快速变化,几乎在
在激活GPCR—腺苷酸环化酶—cAMP-PKA的信号通路中,信号依赖第二信使和激酶级联反应被逐级放大。在GPCR介导的信号转导系统中,又有多种机制使受体功能被下调:一是当
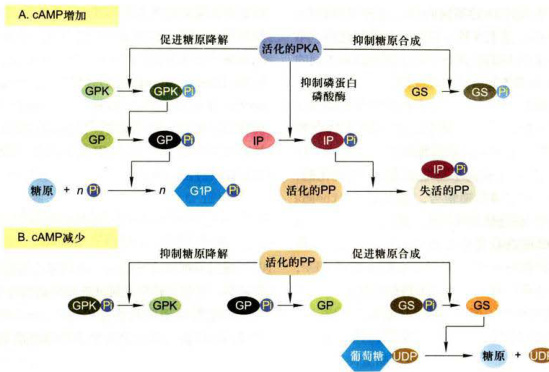
图11-17CAMP-PKA信号通路对肝细胞和肌细胞糖原代谢的调节PKA:蛋白激酶A;PP:磷蛋白磷酸酶;GPK:糖原磷酸化酶激酶:GP:糖原磷酸化酶:GS:糖原合酶;IP:磷蛋白磷酸酶抑制蛋白;G1P:1-磷酸葡糖。
2.cAMP-PKA信号通路对真核细胞基因表达的 调控
cAMP-PKA信号通路对细胞基因表达的调节是一类细胞应答胞外信号缓慢的反应过程,因为这一过程涉及细胞核机制,所以需要几分钟乃至几小时。这一信号通路控制多种细胞内的许多过程,从内分泌细胞的激素合成到脑细胞有关长期记忆所需蛋白质的产生。该信号途径涉及的反应链可表示为:激素→GPCR一G蛋白→腺苷酸环化酶→cAMP→cAMP依赖的PKA→基因调控蛋白(CREB)→基因转录。
信号分子与受体结合通过Gα激活腺苷酸环化酶,导致细胞内cAMP浓度增高,cAMP与PKA调节亚基结合,导致催化亚基释放,被活化的PKA的催化亚基转位进入细胞核,使基因调控蛋白(cAMP应答元件结合蛋白,CREB)磷酸化,磷酸化的CREB与核内CREB结合蛋白(CBP)特异结合形成复合物,复合物与靶基因调控序列(cAMP-responseelement,CRE)结合,激活靶基因的转录(图11-18)。
在讨论GPCR介导的信号通路时,我们不禁要问:为什么不同的信号(配体)通过类似的机制会引发多种不同的细胞反应?这主要取决于GPCR的特异性。首先,对某一特定的配体其受体可以几种不同的异构体形式存在,并对该配体和特定G蛋白有不同的亲和性。现已知肾上腺素受体有9种不同的异构体,5-羟色胺的受体有15种不同的异构体:其次,现已知人类基因组由16个基因至少编码21种不同的Gα,6种不同的
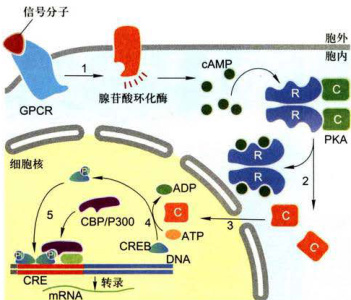
图11-18cAMP-PKA信号通路对基因转录的激活活化的PKA磷酸化基因调控蛋白,进而激活靶基因转录。
有些细菌毒素(toxin)含有一个跨细胞质膜的亚基,能催化
(三)激活磷脂酶C和以
通过GPCR介导的另一条信号通路是磷脂酰肌醇信号通路,其信号转导是通过效应酶磷脂酶C完成的。
细胞肌醇磷脂代谢途径如图11-19所示,双信使
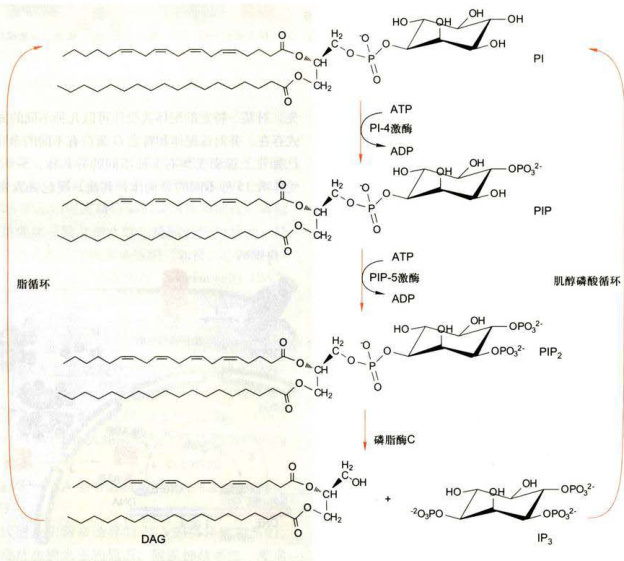
图11-19肌醇磷脂代谢途径:1.4.5-三磷酸肌醇(
1.IP3-Ca2信号通路
胞外信号分子与GPCR结合,活化G蛋白
在细胞中发现的各种磷酸肌醇加到内质网膜泡的制备物中,只有
在细胞信号转导过程的研究中,人们对信号分子与受体的相互作用及其最终的生物学效应已经有了比较多的了解。但是信息是如何在细胞中传递的细节却知之甚少。借助于能与
1993年以来,钙火花
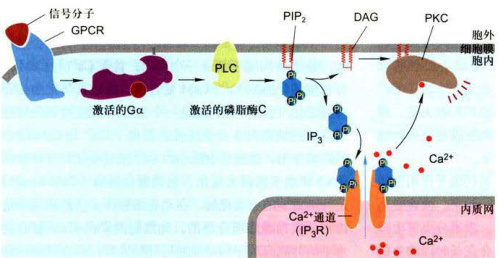
图11-20IP/Ca²*和DAG/PKC双信使信号途径
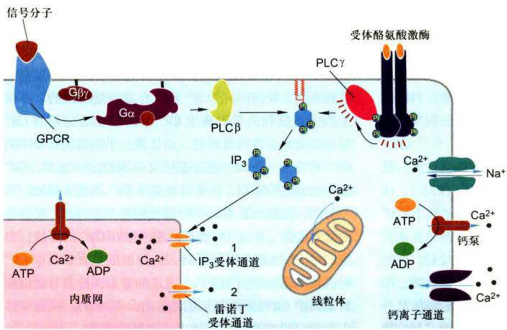
图11-21细胞内Ca水平调控示意图 ;在内质网膜上有两类Ca通道:1.IP受体,即IP门控Ca通道:2.雷诺丁受体(RyR),主要存在于可兴奋细胞(如心肌细胞)中,咖啡因的作用之一就是增强雷诺丁受体对
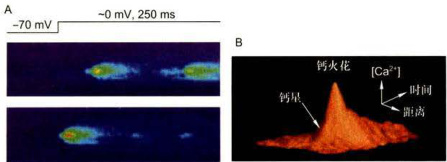
图11-22钙火花;A.Fluo-3染色心肌细胞的共聚焦线扫描显微图像,示钙火花的时间-空间特征。B.钙火花的立体图,高度代表Fluo-3荧光强度。钙星由细胞质膜上钙通道的钙内流形成,通过CICR触发钙火花。(程和平博士惠赠)
钙火花的直径约
钙信号基本单元钙火花的研究,将钙信号作用原理的单一性与其调控和功能的复杂性统一起来。快速变化的钙信号与肌肉收缩、神经递质传递、激素分泌等生理过程直接相关,而不同的钙信号的组合在长时程的生物学过程,如基因表达、细胞调亡以及受精作用中都发挥重要的作用。因此,对钙火花等微区钙信号激活机制、协同机制和终止机制等方面的研究具有非常重要的生理与病理意义。
一般情况
表11-4受钙调蛋白调节的酶
| 酶 | 细胞功能 | 酶 | 细胞功能 |
| 腺苷酸环化酶 | 合成cAMP | 磷酸化酶 | 糖原降解 |
| 鸟苷酸环化酶 | 合成cGMP | 肌球蛋白轻链激酶 | 平滑肌收缩运动 |
| 钙依赖性磷酸二酯酶 | 水解cAMP和cGMP | 钙调蛋白激酶 | 神经递质分泌和再合成,分子记忆 |
| Ca"-ATP酶 | Ca泵 | 钙依赖性蛋白磷酸酶 | 各种蛋白质的去磷酸化 |
| NAD激酶 | 合成NADP | 转谷氨酰胺酶 | 蛋白质交联 |
2.Ca-NO-cGMP-活化的蛋白激酶G信号途径
血管平滑肌细胞的舒张是由该信号通路所诱导的。早在认识NO作为气体信号分子之前,科学家有两个重要发现:20世纪80年代发现在培养条件下巨噬细胞的杀菌活性依赖于培养基中精氨酸的存在,而精氨酸是NO合酶(nitricoxidesynthase,NOS)的底物,提示NO是一种重要的生物功能分子:此外,多年前人们就知道乙酰胆碱(acetylcholine)通过引起平滑肌松弛而舒张血管。1980年R.Furchgott提出血管舒张是因为血管内皮细胞产生一种信号分子引起血管平滑肌松弛所致。随后在1986年Furchgott和L.Ignarro的研究证实,NO作为气体信号分子引起血管平滑肌舒张。正是这些研究贡献使Furchgott等三位美国科学家获得1998年诺贝尔生理学或医学奖。
NO是一种具有自由基性质的脂溶性气体分子,可透过细胞膜快速扩散,作用邻近靶细胞发挥作用。由于体内存在氧及其他与NO发生反应的化合物(如超氧离子、血红蛋白等),因而NO在细胞外极不稳定,其半衰期只有
NO这种可溶性气体,作为局部介质在许多组织中发挥作用,NO发挥作用的主要机制是激活靶细胞内具有鸟苷酸环化酶(guanylatecyclase,GC)活性的NO受体。内源性NO由NOS催化合成后,扩散到邻近细胞,与鸟苷酸环化酶活性中心的
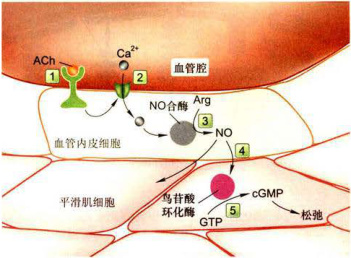
图11-23
-NO-cGMP-活化的蛋白激酶G信号途径 ; 作为血管内皮细胞应答乙酰胆碱GPCR的激活,激活磷脂酶C通过IP-Ca²/CaM激活NO合酶,在血管内皮细胞生成NO,扩散至血管平滑肌细胞激活鸟苷酸环化酶,生成cGMP并作用于PKG,导致血管平滑肌舒张。
3.DAG-PKC信号途径
作为双信使之一的二酰甘油(DAG)结合在质膜 上,可活化与质膜结合的蛋白激酶C(PKC)。PKC有两个功能区,一个是亲水的催化活性中心,另一个是疏水的膜结合区。在静息的细胞中,PKC以非活性形式分布于细胞质中,当细胞接受外界信号刺激时,
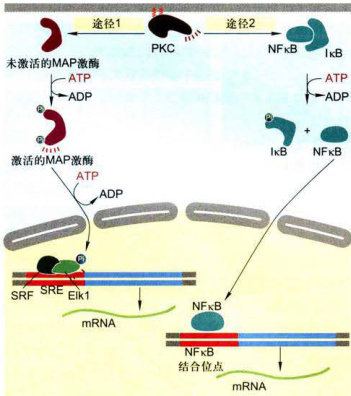
图11-24活化的PKC激活基因转录的两条细胞内途径
一条是PKC激活一系列磷酸化级联反应,导致MAP激酶的磷酸化并使之活化,MAP激酶磷酸化并活化基因调控蛋白EIk1。EIk1与另一种DNA结合蛋白血清应答因子(SRF)共同结合在基因上短的DNA调控序列(血清应答元件,SRE)上。EIK1的磷酸化和活化,即可调节基因转录。另一条途径是PKC的活化导致IKB磷酸化,使基因调控蛋白NFkB与IxB解离并进入细胞核,与相应的基因调控序列结合激活基因转录。
第三节介导并调控细胞基因表达的受体及其信号通路
在细胞表面受体中,G蛋白偶联受体作为最大的多样性家族,其主要生物学效应是通过修饰细胞内酶类和其它蛋白质的活性来调控细胞的代谢反应(短期效应);这一节重点介绍以调控细胞基因表达(长期效应)为主要生物学效应的酶联受体(受体酪氨酸激酶、细胞因子受体等)所介导信号通路及其他调控基因表达的重要信号通路。在真核细胞中,大约有12类高度保守的细胞表面受体,激活几类高度保守的细胞内信号转导途径,调控多种细胞基因的表达。某些哺乳类细胞表达上百种不同类型的细胞表面受体,每种受体又可结合不同的配体。任何一个基因的表达既受多种转录因子的调节,也受多种细胞外信号的调控,这是一种多级可控的复杂过程。
一、酶联受体及其介导的细胞信号转导通路
(一)受体酪氨酸激酶和细胞因子受体的结构特征与作用机制
在人类基因组中,大约有90种蛋白质磷酸激酶受体,分属两大类催化型酶联受体(enzyme-linkedreceptor),即受体酪氨酸激酶(receptortyrosinekinase,RTK)和细胞因子受体(cytokinereceptor)。再进一步细分至少包括5类: (1)受体酪氨酸激酶; (2) 受体丝氨酸/苏氨酸激酶; (3) 受体酪氨酸磷酸酯酶: (4) 受体鸟苷酸环化酶;(5)酪氨酸蛋白激酶偶联的受体。
目前已知受体酪氨酸激酶(RTK)和细胞因子受体这两类受体家族具有类似的结构特征和作用机制: (1)具有类似的结构,绝大多数是单次跨膜蛋白,其
(二)受体酪氨酸激酶介导的RaS-MAK激酶信号通路
几乎所有RTK和细胞因子受体都能介导Ras-MAK激酶信号通路。
1.胞外信号分子与接头蛋白
激活RTK的胞外信号分子是可溶性或膜结合的多肽或蛋白类激素,包括多种生长因子、胰岛素(insulin)和胰岛素样生长因子等。许多RTK和它们的配体,在研究人类癌症过程中已被鉴定,因为一些癌症的发生与生长因子受体的突变相关,受体突变即使在缺乏生长因子的情况下也会刺激细胞增殖,或者说这类受体始终处于组成型活化状态。其他一些RTK在分析线虫、果蝇和小鼠的发育突变中也被发现,因为这类突变导致阻断某些细胞类型的分化。
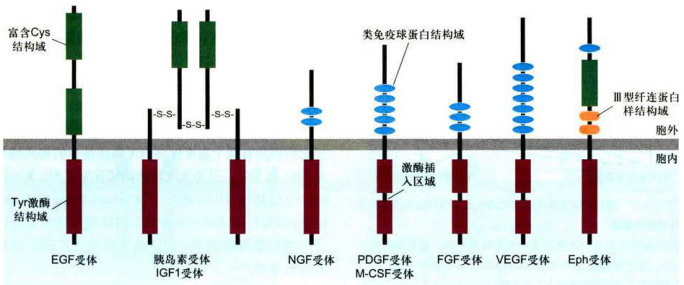
图11-25受体酪氨酸激酶的7个亚族
每个亚族只标示了1~2个成员:表皮生长因子(EGF)受体、胰岛素和胰岛素样生长因子1(IGF1)受体、神经生长因子(NGF)受体、血小板衍生生长因子(PDGF)和巨噬细胞集落刺激因子(M-CSF)受体、成纤维细胞生长因子(FGF)受体、血管内皮生长因子(VEGF)受体和肝配蛋白Eph受体亚族。肝配蛋白(Ephrin,Eph)受体亚族是一大类与膜结合配体相互作用的受体,人类基因组中已鉴定8个成员,主要功能是刺激血管发生、指导细胞和轴突迁移。在一些亚族中酪氨酸蛋白激酶的结构域被激酶插入区所中断。关于富含半胱氨酸和类免疫球蛋白结构域的功能意义尚不清楚。
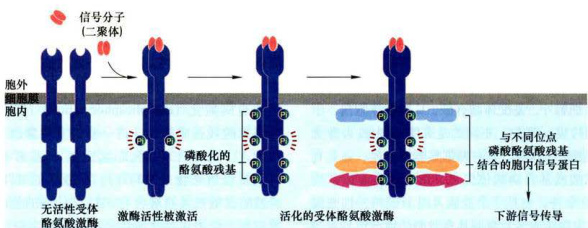
图11-26配体结合所诱导的受体酪氨酸激酶的二聚化与自磷酸化图解;1.当细胞处于“静息”状态(没有结合配体),RTK固有的激酶活性很低,激酶结构域柔韧的活化唇(activationip)未被磷酸化而呈现阻断激酶活性的构象:2.配体结合,引发构象改变,促进受体二聚化,活化唇部位特定的酪氨酸残基被交叉磷酸化,解除激酶活性的阻断状态3.受体胞内段其他酪氨酸残基被进一步交叉磷酸化,结果促进蛋白激酶被激活,并提供下游信号蛋白的锚定位点。
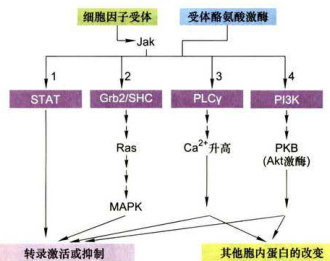
图11-27两类酶联受体通过活化酪氨酸蛋白激酶所介导的信号转导通路示意图 ;RTK和细胞因子受体激活多种信号转导途径,最终调控基因转录。1.主要由细胞因子受体介导的最直接的信号通路:一种STAT转录因子与活化受体结合并被磷酸化,进入核内直接激活转录。2.一类接头蛋白(Grb2或Shc)与活化受体结合,导致激活Ras-MAP激酶信号途径。3,4.通过募集磷脂酶
(PLC)和磷脂酰肌醇3激酶(PI3K)到质膜上引发两种肌醇磷脂途径:通过升高 和激活蛋白激酶B(PKB)调解转录因子以及胞质蛋白活性,从而致使转录激活或阻遇以及修饰其他蛋白影响细胞代谢或细胞运动或细胞形状。
如前所述,活化的RTK通过磷酸化受体胞内段特定的酪氨酸残基,作为锚定位点可以结合多种细胞质中带有SH2结构域的蛋白。其中一类是接头蛋白(adapterprotein),如生长因子受体结合蛋白2(Grb2),其作用是偶联活化的RTK受体与其他胞内信号蛋白,参与构成细胞内信号转导复合物,但它本身不具酶活性,也没有传递信号的性质;另一类是在信号通路中有关的酶,如GTP酶活化蛋白(GTPase activatingprotein,GAP)、肌醇磷脂代谢有关的酶(磷脂酶
2.Ras蛋白
在许多真核细胞中,Ras蛋白在RTK介导的信号通路中也是一种关键组分。Ras蛋白(分子质量 21
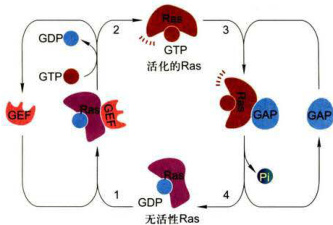
图11-28RaS蛋白GTP-GDP转换与机制
具有鸟苷酸交换因子活性的Sos蛋白(Ras-GEF,来自son-of-sevenless缩写,Sos)与Ras结合引发导致Ras活化的构象改变,使非活性的Ras-GDP转换成有活性的Ras-GTP。对线虫和果蝇发育的特定分化阶段的突变遗传分析发现,也证实上述两种胞质蛋白在联系RTK与Ras蛋白的活化之间具有关键作用。
在酶联受体介导的信号通路中,Ras蛋白是活化受体RTK下游的重要功能蛋白。二者之间通过接头蛋白和Ras蛋白-鸟苷酸交换因子(Ras-GEF)起重要联系作用。实验证明,用PDGF和EGF混合物处理培养的成纤维细胞诱导细胞增殖,如果这些细胞显微注射抗Ras抗体则阻断细胞增殖;反之,如果注射Ras(一种组成型活化的突变Ras蛋白),它不能有效地水解GTP并维持细胞持续的活化状态,结果诱发细胞在缺少生长因子的情况下进行增殖。如图11-29所示,两种胞质蛋白提供了关键性联系:一个是生长因子受体结合蛋白Grb2,具有SH2结构域可直接与活化受体特异性磷酸酪氨酸残基结合,Grb2还具有两个SH3结构域能结合并激活另一种胞质蛋白Sos,即Grb2作为一种接头蛋白既与活化受体上特异磷酸酪氨酸残基结合又与胞质蛋白鸟苷酸交换因子Sos结合,促进在膜上形成胞内信号转导复合物,复合物的形成又有利于在Sos作用下促进Ras蛋白结合的GDP/GTP交换而被激活。
Ras蛋白的活化是通过配体与RTK的结合而诱导的,而Ras蛋白的活化对诱导不同类型细胞的分化或增殖又是必要而充分的,然而在有些突变细胞中组成型地活化Ras蛋白,即使在缺少信号刺激情况下,细胞也会发生应答反应。已有大量研究表明,约
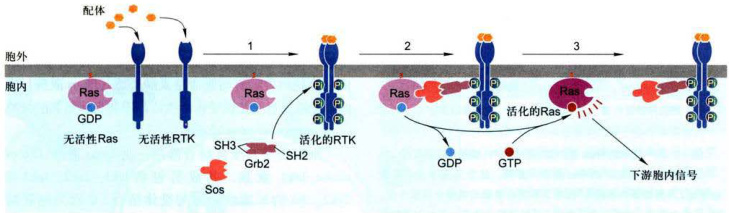
图11-29伴随配体与RTK(或细胞因子受体)结合,Ras蛋白的活化 ;1.配体与受体结合导致二聚化和受体激活,形成磷酸酪氨酸残基特异性锚定位点:2.胞质Grb2接头蛋白与活化受体特异性磷酸酪氨酸残基和胞质Sos蛋白结合,在质膜胞质面形成细胞内信号转导复合物:3.鸟苷酸交换因子Sos的活性促进GDP-GTP转换,形成活化的Ras-GTP。
3.Ras-MAPK磷酸化级联反应
Ras-MAPK磷酸化级联反应,是细胞如何克服Ras活化所能维持的时间较短、不足以保障细胞增殖与分化所需持续性信号刺激的重要机制。Ras-MAPK磷酸化级联反应始于质膜下活化的Ras蛋白(Ras-GTP),终止于促分裂原活化的蛋白激酶(MAPK)。在酵母、线虫、果蝇和哺乳类的生化及遗传研究中,已经揭示Ras的下游通路是高度保守的三种激酶的级联反应,在MAPK终结(图11-30)。这一保守信号通路参与调控细胞生长、发育、分化、凋亡等多种生理过程。
多种信号蛋白如Ras、酪氨酸激酶Src、蛋白激酶C、蛋白激酶B等都可通过激活不同的Raf激活下游通路,Raf是已知处在丝氨酸/苏氨酸(Ser/Thr)蛋白激酶最上一级的激酶(促分裂原活化的蛋白激酶激酶激酶,MAPKKK),其中Ras蛋白激活Raf是最具代表性的。Ras-MAPK磷酸化级联反应的基本步骤如下:
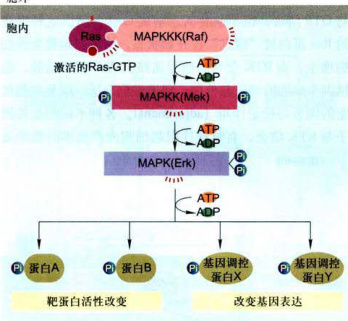
图11-30活化的Ras蛋白激活的MAPK磷酸化级联反应
活化的、结合GTP的Ras蛋白,募集、结合并激活Raf蛋白(丝氨酸/苏氨酸蛋白激酶),起始三种蛋白激酶的磷酸化级联反应,增强和放大信号,级联反应的最后,才能磷酸化修饰一些基因调控蛋白,改变基因表达模式。这是最终导致细胞行为改变的关键。MAP:促分裂原活化蛋白质:Erk
(1)活化的Ras蛋白与Raf的N端调控结构域结合并使其激活,它使靶蛋白上的丝氨酸/苏氨酸残基磷酸化:丝氨酸/苏氨酸残基磷酸化的蛋白质代谢周转比酪氨酸残基磷酸化的蛋白质慢,这有利于使短寿命的Ras-GTP信号事件转变为长寿命的信号事件。
(2)活化的Raf结合并磷酸化另一种蛋白激酶Mek(促分裂原活化的蛋白激酶激酶,MAPKK),使其丝氨酸/苏氨酸残基磷酸化导致MAPKK的活化。
(3)MAPKK是一种双重特异的蛋白激酶,它能磷酸化其唯一底物MAPK的苏氨酸和酪氨酸残基使之激活。
(4)MAPK在该信号通路的蛋白激酶磷酸化级联反应中是一种特别重要的组分,中文译名为促分裂原活化的蛋白激酶(mitogen-activatedproteinkinase,MAPK),活化的MAPK进入细胞核,可使许多底物蛋白质的丝氨酸/苏氨酸残基磷酸化,包括调节细胞周期和细胞分化的特异性蛋白表达的转录因子,从而修饰它们的活性。
(三)细胞质因子受体与JAK/STAT信号通路
细胞因子(cytokine)是由细胞分泌的影响和调控多种类型细胞增殖、分化与成熟的活性因子,包括白细胞介素(interleukin,IL)、干扰素(interferon,IFN)、集落刺激因子(colony-stimulatingfactor,CSF)、促红细胞生成素(erythropoietin,Epo)和某些激素(如生长激素和催乳素)等,它们组成一个信号分子家族,其成员分子量相对较小,通常由约160个氨基酸组成。细胞因子对多种细胞类型的发育,特别是在造血细胞和免疫细胞的生长、分化与成熟中起重要调控作用。
细胞因子受体是细胞表面一类与酪氨酸激酶偶联的受体。这类受体的结构与活化机制和RTK非常相似,受体所介导的胞内信号通路也多与RTK介导的胞内信号通路相似或重叠。细胞因子受体本身不具有酶活性,但它的胞内段具有与胞质酪氨酸激酶(Janus激酶)的结合位点,也就是说受体活性依赖于非受体酪氨酸激酶(nonreceptor tyrosine kinase)。
细胞因子与受体结合激活一类Janus激酶(Januskinase,Jak)家族,其成员包括Jak1、Jak2、Jak3和Tyk2。Jak的N端结构域与受体结合,C端为酪氨酸激酶结构域。每种激酶成员与特异的细胞因子受体结合。研究Epo受体所介导的信号转导通路时,在激酶的直接底物中发现一类新的衔接子蛋白是基因转录调节因子,称为信号转导子和转录激活子(signaltransducerand activator oftranscription,STAT),STAT蛋白N端具有SH2结构域和核定位信号(NLS),中间为DNA结合域,C端有一个保守的酪氨酸残基,对其活化至关重要。目前已发现的STAT家族成员有7个,分别命名为STAT1至STAT6,其中STAT5又分为STAT5A和STAT5B两个成员,具有信号转导和转录激活的双重功能,因此细胞因子受体介导的信号通路又称为Jak-STAT信号通路(图11-31)。
该信号通路是人们在研究干扰素诱导培养细胞特定基因转录的调控作用时发现的,继后发现该通路对细胞增殖、分化、迁移和凋亡等生物学过程都具有重要的调节作用。目前已在人类肿瘤中发现了STAT3信号的异常持续活化,同时在对基因敲除小鼠表型的研究中,也显示Jak-STAT信号通路与某些疾病的发生,如心血管疾病、肥胖症、糖尿病以及支气管哮喘等可能起关键的调控作用。
Jak-STAT信号通路的基本步骤:
(1)细胞因子与细胞因子受体特异性结合,引发受体构象及紧密结合的Jak构象改变并形成同源二聚体。受体二聚化有助于各自结合的Jak相互靠近,使彼此酪氨酸残基发生交叉磷酸化,从而完全激活Jak的活性。
(2)活化的Jak继而磷酸化受体胞内段特异性酪氨酸残基,使活化受体上磷酸酪氨酸残基成为具有SH2结构域的STAT或具有PTB结构域的其他胞质蛋白的锚定位点。
(3)STAT通过SH2结构域与受体磷酸化的酪氨酸残基结合,继而STAT的C端酪氨酸残基被Jak磷酸化。磷酸化的STAT分子即从受体上解离下来。
(4)两个磷酸化的STAT分子依靠各自的SH2结构域结合形成同源或异源二聚体,从而暴露其核定位信号NLS。二聚化的STAT转位到细胞核内与特异基因的调控序列结合,调节相关基因的表达。
细胞因子受体与STAT的结合具有特异选择性,这基于受体胞内段不同位点的磷酸酪氨酸残基结合不同的STAT分子,例如,干扰素α受体识别STAT1和STAT2,而干扰素
细胞因子(Epo)除通过Jak-STAT通路调控基因转录外,还有其他信号转导途径调控基因的转录(图11-32)
(四)PI3K-PKB(AKt)信号通路
1.PI3K-PKB(Akt)信号通路及其组成
PI3K-PKB(Akt)信号通路始于RTK和细胞因子受体的活化,产生磷酸化的酪氨酸残基,从而为募集PI3K向膜上转位提供锚定位点。
磷脂酰肌醇3激酶(PI3K)最初是在多瘤病毒(polyoma,一种DNA病毒)研究中被鉴定的。迄今发现在人类基因组中PI3K家族有9种同源基因编码,
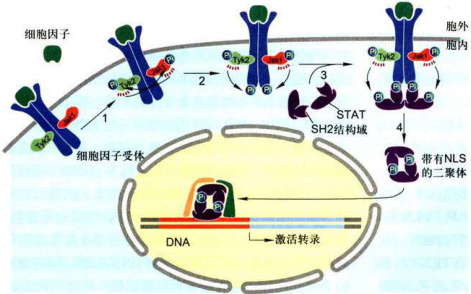
图11-31Jak-STAT信号通路
在没有结合配体时,细胞因子受体的胞质结构域与一类Jak紧密而不可逆地结合。虽然受体已二聚化形成同源二聚体,但Jak只有很低的活性。特异性细胞因子与受体结合后,引发Jak构象改变和酪氨酸残基被交叉磷酸化,继而受体的酪氨酸残基也被活化激酶交叉磷酸化,产生具有SH2结构域的STAT的锚定位点。两个磷酸化的STAT分子从受体上解离下来,靠各自的SH2结构域结合形成同源二聚体,并借助其核定位信号NLS转位至核内,调控基因表达。
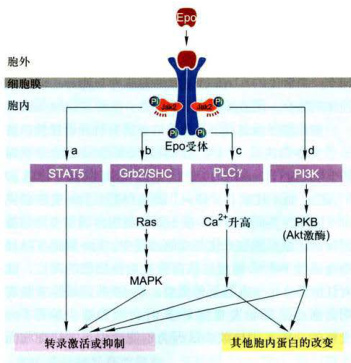
图11-32促红细胞生成素(Epo)及其受体所介导的信号转导途径概观
PI3K既具有Ser/Thr激酶活性,又具有磷脂酰肌醇激酶的活性。PI3K由两个亚基组成:一个pl10催化亚基;一个p85调节亚基,具有SH2结构域,可结合活化的RTK和多种细胞因子受体胞内段磷酸酪氨酸残基,从而被募集到质膜,使其催化亚基靠近质膜内的磷脂酰肌醇。在膜脂代谢中,具有磷脂酰肌醇激酶活性的PI3K催化PI4P生成
许多蛋白激酶都是通过与质膜上PI3P锚定位点的结合而被激活的,这些激酶再影响细胞内许多靶蛋白的活性。蛋白激酶B(PKB)是一种分子质量约
2.PI3K-PKB信号通路的生物学作用
PI3K-PKB信号通路参与多种生长因子、细胞因子和细胞外基质等的信号转导,具有广泛的生物学效应,特别在防止细胞凋亡,促进细胞存活以及影响细胞糖代谢等方面具有重要作用。
(1)PI3K-PKB信号通路对细胞生存的促进作用是活化的PKB所诱发的诸多细胞反应中最值得关注的事件。虽然活化PKB仅需
(2)PI3K-PKB信号通路的另一个重要生物学作用是促进胰岛素刺激的葡萄糖摄取与储存。在没有胰岛素存在的情况下,细胞内糖原合酶激酶3(GSK3)是活化的,可将糖原合酶(GS)磷酸化致使失去活性;在有胰岛素刺激的情况下,也可启动PI3K-PKB信号途径,结果活化的PKB使GSK3的N端一个Ser残基磷酸化而变成无活性形式,从而解除对GS的抑制,促进糖原的合成。此外,在肌细胞和脂肪细胞,活化的PKB还
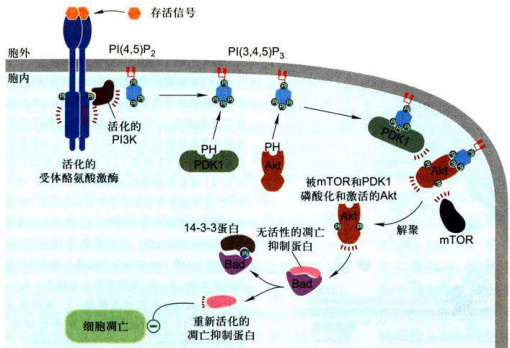
图11-33PI3K-PKB信号通路
作为RTK介导的衍生信号通路,第一步是具有SH2结构域的PI3K被募集到质膜,催化膜脂代谢:第二步是PKB凭借PH结构域与3位磷酸基团结合而转位到质膜上,使PKB被自身PH结构域抑制的催化位点的活性得以释放;第三步是在两种Ser/Thr蛋白激酶(PDK1和PDK2通常是mTOR)进一步磷酸化PKB活性位点上的关键苏氨酸残基和丝氨酶残基,致使PKB完全活化:并在细胞质内或转位到核内通过修饰下游靶蛋白影响,产生影响细胞行为的广泛效应。
能诱发胰岛素依赖性葡糖转运蛋白4(glucosetransporter4,Glut4)从细胞内膜转移到细胞表面,促进细胞对葡萄糖的摄取。通过增强糖原合成和促进葡萄糖摄取而使血糖降低。
此外,越来越多的证据表明,在细胞内蛋白质分选或内吞/内化过程中,PI3K是重要的调节因子。活化的PI3K可导致高尔基体TGN或质膜局部区域产生高水平的
(五)TGFβ受体及其TGFβ-Smad信号通路
转化生长因子
TGFβ超家族成员都是通过细胞表面酶联受体而发挥作用的。根据
尽管TGFβ可以诱发复杂而多样的细胞反应,但TGFβ受体所介导的信号转导通路却又相对简单而且基本相同,即一旦受体与配体结合形成复合物后便被激活,那么受体的激酶活性就能在细胞质内直接磷酸化并激活特殊类型的转录因子Smad,进入核内调节基因表达,故称
在TGFβ-Smad信号通路中,Smad蛋白最初在线虫和果蝇发现,分别是Sma和Mad,而后在爪蟾、小
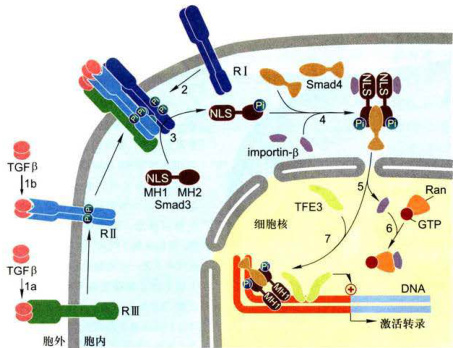
图11-34TGFβ-Smad信号通路
1a.某些细胞中,TGFβ与RⅢ受体结合,并由R将信号分子传递给RII受体(具有组成型激酶活性):1b.有些细胞中,信号分子直接与RII受体结合。2.结合配体的RII受体募集并磷酸化RI受体(RI受体不直接结合配体),RI受体激酶活性的抑制被释放。3.活化的RI受体磷酸化Smad或另外R-Smad,引起构象改变,解除NLS的掩蔽。4.两分子磷酸化的R-Smad(Smad3)与未磷酸化的co-Smad(Smad4)以及importin
鼠和人类中又发现其相关蛋白质,故以Sma和Mad的缩写Smad家族命名这类基因转录调控蛋白。现已知有三种Smad转录因子起调控作用,包括受体调节的R-Smad(Smad2、Smad3)、辅助性Smad(co-Smad,Smad4)和抑制性或拮抗性I-Smad(importin
在核内R-Smad发生去磷酸化,结果R-Smad/co-Smad复合物解离,又从核内输出进入细胞质。由于Smad持续的核-质穿梭,所以细胞核中活化的Smad浓度可以很好地反映细胞表面活化的TGFβ受体的水平。
二、其他调控基因表达的细胞表面受体及其介导的信号转导通路
按其信号通路的组成和调控机制不同,可将这类受体分作两类:一类是Wnt受体和Hedgehog受体介导的信号通路:另一类是
(一)Wnt受体和Hedgehog受体介导的信号通路
Wnt受体和Hedgehog受体具有与7次跨膜与GPCR相似的结构,但并不激活G蛋白;两种受体在细胞处于“静息”状态下,两条相关的信号通路中其关键转录因子被泛素化修饰,进而被蛋白酶体识别和切割降解,表现为失活状态;信号通路的激活涉及大的胞质蛋白复合物的解体(去装配)、泛素化的抑制和活性转录因子的释放,再转位到核内调控基因表达。
1.Wnt-β-catenin(β-联蛋白)信号通路
Wnt是一组富含半胱氨酸的分泌性糖蛋白,作为局域性信号分子,广泛存在于各种动物多种组织中。小鼠Wntl基因是最先发现的脊椎动物Wnt基因,由于某些乳腺癌的发生与它的过度表达有关,所以Wnt基因倍受关注,仅在人类中所发现的Wnt蛋白家族成员已多达19个。Wnt来源于wingless和
该信号通路的膜受体,Frzzled(Fz)是与GPCR相似的7次跨膜细胞表面受体,直接与Wnt结合;另一个辅助性受体(co-receptor)LRP5/6(LDL-receptor-relatedprotein,LRP),一次跨膜,以
在细胞内Wnt信号转导中,多功能的
Wnt-
Wnt-
2.Hedgehog受体介导的信号通路
Hedgehog(Hh)是一种由信号细胞所分泌的局域性蛋白质信号分子,作用范围很小,一般不超过20个细胞。 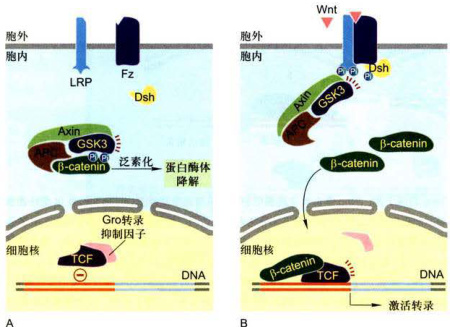
图11-35Wnt-β-catenin信号通路
A.缺乏Wnt信号,β-catenin与Axin介导的胞质蛋白复合物结合,利于
Hedgehog信号通路,在脊椎和无脊椎动物的诸多发育过程中,控制细胞命运、增殖与分化,该信号通路被异常激活时,会引起肿瘤的发生与发展。该信号蛋白诱导不同的细胞命运依赖于Hh信号分子的浓度。和其他形态生成素(morphogen)一样,它的产生在时间与空间上受到严格控制。Hedgehog在细胞内是以前体(precursor)形式合成与分泌的,在细胞外发生自我催化性降解,然后在N端不同氨基酸残基位点发生胆固醇化和软脂酰化(palmitoylation)修饰,从而制约其扩散并增加其与质膜的亲和性。
Hedgehog受体有三种跨膜蛋白:Patched(Ptc)、Smoothened(Smo)和iHog,介导细胞对Hh信号的应答反应。Ptc和Smo具有接受和转导Hh信号的功能,膜蛋白iHog可能作为辅助性受体参与Ptc与Hh信号的结合。在缺乏Hh信号情况下,Ptc主要存在于质膜上,以尚未明确的机制,保持
基于在果蝇中大量的研究,Hedgehog信号通路的基本模型如图11-36所示:在缺乏Hh信号情况下(图11-36A),受体Ptc蛋白抑制胞内膜泡上的Smo蛋白,胞质调节蛋白形成复合物并与微管结合,在复合物中关键的转录因子Ci被各种激酶磷酸化,磷酸化的Ci在泛素/蛋白酶体相关的F-box蛋白Slimb的作用下水解形成Ci75片段,作为Hh应答基因的阻遇物发挥作用,进入核内抑制靶基因表达。在有Hh存在情况下(图11-36B),Hh与Ptc结合抑制Ptc活性,引发Ptc内化并被消化,从而解除对
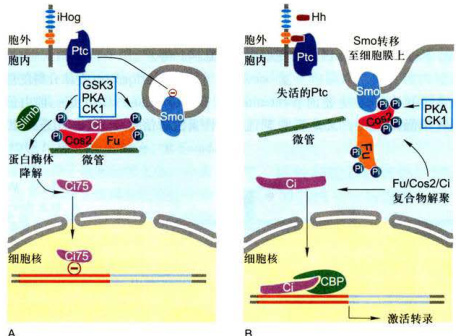
图11-36Hedgehog信号通路示意图
Hedgehog受体有三种跨膜蛋白:Ptc跨膜12次,Smo跨膜7次,iHog蛋白单次跨膜但胞外段具有类免疫球蛋白(lg)和类型纤连蛋白(FN)结构域。A.缺乏Hh信号情况下,受体Ptc蛋白抑制胞内膜泡上的Smo蛋白,细胞内形成胞质调节蛋白复合物并与微管结合,在复合物中关键的转录因子Ci被各种激酶磷酸化,磷酸化的Ci作为靶标由泛素/蛋白酶体相关蛋白(Simb)的作用下水解形成Ci75片段,此片段作为Hh应答基因的阻退物发挥作用,进入核内抑制靶基因表达。B.在有Hh存在情况下,Hh与Ptc结合抑制Ptc活性,引发Ptc被内吞、消化,从而解除对Smo的抑制,然后Smo通过膜泡融合移位到质膜,并被CK1和PKA两种激酶磷酸化,与Smo结合的Cos2和Fu蛋白超磷酸化,致使Fu/Cos2/Ci复合物从微管上解离下来并去装配,从而形成稳定形式的Ci,进入核内并与CREB结合蛋白(CBP)结合,作为靶基因的转录激活子而发挥作用。
Smo结合的Cos2和Fu蛋白超磷酸化,致使Fu/Cos2/Ci复合物从微管上解离下来,从而形成稳定形式的Ci,进入核内并与CREB结合蛋白(CBP)结合,作为靶基因的转录激活子而发挥作用。
(二)NFkB和Notch信号通路
按其信号通路的组成和调控机制,
1.NFB信号通路
NFkB最初是R.Sen和D.Baltimore于1986年在B细胞中发现的一种核转录因子,能特异性结合免疫球蛋白K轻链基因的上游增强子序列并激活基因转录。此后发现它广泛存在于几乎所有真核细胞,故而命名。NFkB信号通路可调控多种参与炎症反应的细胞因子(如IL1、IL6、TNFα)、黏附因子和蛋白酶类基因的转录过程,以应答细胞对多种胞外信号刺激,包括病毒侵染、细菌和真菌感染、肿瘤坏死因子、白细胞介素等细胞因子,甚至离子辐射,产生的免疫、炎症和应激反应,并影响细胞增殖、分化及发育。
NFkB蛋白家族包括五个含有Relhomologydomain(RHD)的蛋白,即RelA、RelB、c-Rel、p50和p52,它们之间分别形成同源或异源二聚体,在“静息”状态下存在于细胞质中,在N端共享一个同源区,以确保其二聚化并与DNA结合,核定位信号(NLS)也位于此同源区。
如图11-37所示,在细胞处于“静息”状态下,NFkB在细胞质中与一种抑制物
在多种免疫系统细胞中,受NFkB激活转录的基因有150多种,包括编码细胞因子和趋化因子(chemokine)的基因,在炎症反应中
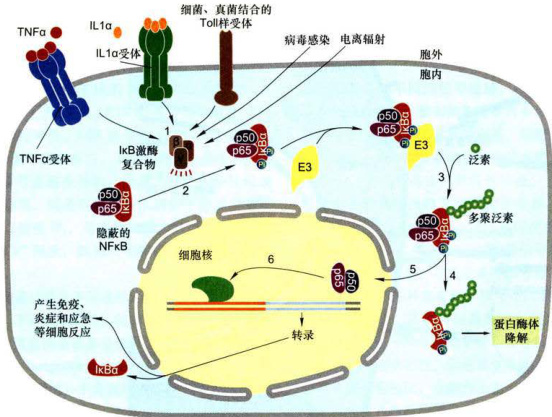
图11-37NFB信号通路图解(步骤见正文)
NFKB信号的终止是负向调节的关键,其中活化的NFKB除激活靶基因转录外,还能激活
2.Notch信号通路
Notch信号通路是一种细胞间接触依赖性的通信方式。信号分子及其受体均是膜整合蛋白。信号转导的启动依赖于信号细胞的信号蛋白与相邻应答细胞的受体蛋白的相互作用,信号激活的受体发生两次切割,释放转录因子,调节应答细胞的分化方向,决定细胞的发育命运。
Notch受体蛋白是由Notch基因编码的膜蛋白受体家族,从无脊椎动物到人类广泛表达,在结构上具有高度保守性。Notch受体蛋白的胞外区包含多个EGF样的重复序列及其与配体的结合位点;胞内区含多种功能序列,是Notch受体蛋白完成信号转导的关键区域。Notch的配体又称DSL(其名源于果蝇Notch配体Delta、Serrate和线虫Lag2的首字母缩写)。
如图11-38所示,Notch蛋白首先以单体膜蛋白形式在内质网合成,然后转运至高尔基体,在反面网状区被蛋白酶切割,产生一个胞外亚基和一个跨膜-胞质亚基;在没有与其他细胞的配体相互作用时,两个亚基彼此以非共价键结合(步骤1)。随着与相邻信号细胞的配体(Delta)的结合,应答细胞的Notch蛋白便发生两次蛋白切割过程:Notch蛋白首先被结合在膜上的基质金属蛋白酶(matrixmetalloprotease)ADAM(源于adisintegrinandmetalloprotese首字母缩写)切割,然后释放出Notch的胞外片段(步骤2);第二次切割发生在Notch蛋白疏水的跨膜区,由4个蛋白亚基组成的跨膜复合物Y分泌酶(-secretase)负责催化完成,切割后释放Notch蛋白的胞质片段(步骤3);该胞质片段是Notch的活性形式,它立即转位到核内与其他转录因子协同作用,调节靶基因的表达,从而影响发育过程中细胞命运的决定(步骤4)。
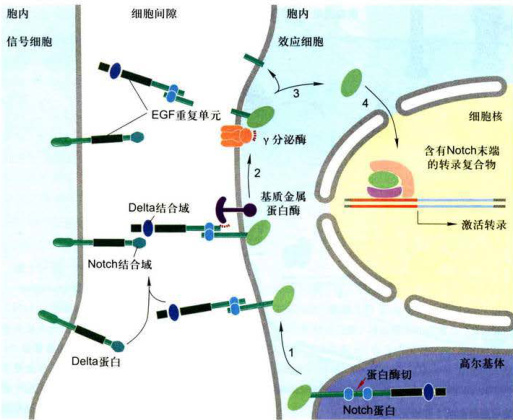
图11-38Notch/Delta信号通路图解(步骤见正文)
第四节细胞信号转导的整合与控制
细胞的信号转导是多通路、多环节、多层次和高度复杂的可控过程。在许多情况下,细胞的适当反应依赖于接收信号的靶细胞对多种信号的整合以及对信号有效性的控制。
一、细胞对信号的应答反应具有发散性或收敛性特征
对特定胞外信号产生多样性细胞反应的机制通常有三种情况:
(1)细胞外信号的强度或持续时间的不同控制反应的性质。例如,在体外培养条件下,神经生长因子(NGF)诱导PCI2细胞分化为神经细胞;而上皮生长因子(EGF)则诱导PCI2细胞分化为脂肪细胞。通过延长生长因子刺激时间来强化EGF信号强度,则又转而引起神经细胞分化。虽然两种生长因子NGF和EGF都是RTK的配体,但与EGF相比,NGF是Ras-MAPK信号转导通路更强的激活子(activator),而EGF受体只有延长刺激时间才可能激活这条信号通路。
(2)在不同细胞中,具有同样受体,但因不同的胞内信号蛋白,可引发不同的下游通路。在线虫(C.elegans)研究中已经证明,RTK受体介导的下游通路具有细胞类型特异性。EGF信号在不同的细胞类型中至少可诱发5种不同的反应,其中4种反应是由共同的Ras-MAPK信号通路介导的,而第5种反应涉及雌雄同体的排卵作用,则是利用一种不同的下游途径,该途径产生第二信使
(3)细胞通过整合不同通路的输入信号调节细胞对信号的反应。不同类型的受体特异性识别并结合各自配体,这些信号通过两条或多条信号途径,在向下游传递时经整联蛋白(integratorprotein)在细胞内汇聚、收敛(convergence)去激活一个共同的效应器(如Ras或Raf蛋白),从而引起细胞生理、生化反应和细胞行为的改变(图11-39);来自细胞表面同一类受体(如Epo受体)激活Jak也可引发多种信号途径,导致信号传播的发散(divergence),调节不同的基因表达,产生不同生理效应(见图11-32)。
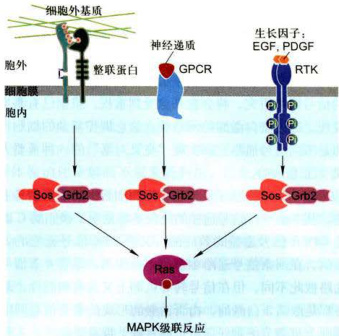
图11-39细胞应答信号反应的收敛性特征来自细胞表面GPCR、整联蛋白和受体酪氨酸激酶所转导的信号都收敛到Ras蛋白,然后沿MAPK级联反应途径向下传递。
二、蛋白激酶的网络整合信息
细胞各种不同的信号通路,主要提供了信号途径本身的线性特征,然而细胞需要对多种信号进行整合和精确控制,最后作出适宜的应答。细胞信号转导最重要的特征之一是构成复杂的信号网络系统(signalnetworksystem),它具有高度的非线性特点。人们对信号网络系统中各种信号通路之间的交互关系,形象地称之为“交叉对话”(crosstalk)。或许可以把细胞信号转导比喻为电脑的工作,细胞接受的外界信号如同键盘输入的不同的字母或符号,细胞内各种信号通路及其组分如同电脑线路中的各种集成块,信号在这些集成块中流动,经分析、整合,最后将结果显示在荧光屏上。在细胞中,这些经信号网络系统分析、整合后的信号最终表现为特定的生理学功能。但是最复杂的电脑恐怕也无法和最简单的细胞相比,电脑作为无生命的机械装置,简单的操作失误或线路故障,都可导致整个系统的瘫痪;而细胞则有一定的自我修复和补偿能力。
虽然我们对细胞信号系统的研究有了长足进展,但对其复杂关系的了解仍然是初步的。细胞信号系统的网络化相互作用是细胞生命活动的重大特征,也是细胞生命活动的基本保障之一。今后对以调节基因表达为主线的信号网络研究,将会愈来愈受到重视。根据已有事实发现,通过蛋白激酶的网络整合信息调控复杂的细胞行为是不同信号通路之间实现“交叉对话”的一种重要方式(图11-40)。
图11-40概括了从细胞表面到细胞内的主要信号通路,从5条平行信号途径的比较不难发现:磷脂酶C既是GPCR信号途径的效应酶,又是RTK信号途径的效应酶,在两条信号通路中都起中介作用:尽管4条信号通路彼此不同,但在信号转导机制上又具有相似性,最终都是激活蛋白激酶,由蛋白激酶形成的整合信息网络原则上可调节细胞任何特定的过程。据最近统计,人类基因组编码蛋白激酶多达560种。因此不难理解蛋白激酶的网络整合信息是不同信号通路之间实现“交叉对话”的一种重要方式。
事实上,细胞信号网络的复杂性远比我们所了解的多。首先,还有许多信号途径不为人们所了解;其次,对主要途径的相互作用,我们只涉及了蛋白激酶,其他的正负调控及“交叉对话”却没有述及。对细胞信号转导过程中这些内容的研究和对信号传递过程非线性内涵的认识,将对我们深入了解多基因表达调控机制、发育机理、病理过程及疾病控制等方面产生
重要的影响。
三、信号的控制:受体的脱敏与下调
典型哺乳类细胞针对某种特殊配体的细胞表面受体,只占质膜总蛋白的
细胞对外界信号作出适度的反应既涉及到信号的有效刺激和启动,也依赖于信号的解除与细胞的反应终止,特别值得注意的是信号的解除与终止和信号的刺激与启动对于确保靶细胞对信号的适度反应来说同等重要。解除与终止信号的重要方式是在信号浓度过高或细胞长时间暴露某一种信号刺激的情况下,细胞会以不同的方式致使受体脱敏(desensitization),这种现象又称之为适应(adaptation),这是一种负反馈调控机制。以视杆细胞对周围光强度变化的适应为例,由光激活的视蛋白(opsin,O)是视紫红质激酶(rhodopsinkinase)的底物,活化的视蛋白其胞质面三个丝氨酸残基恰是视紫红质激酶的磷酸化位点,视蛋白的磷酸化一方面显著降低
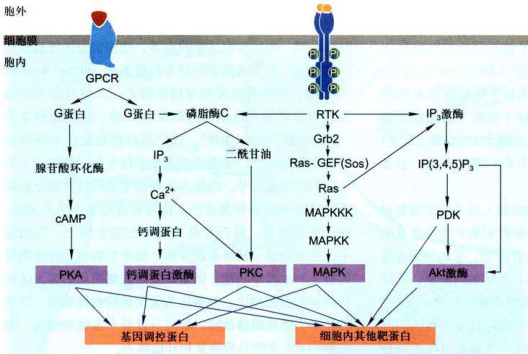
图11-40由两类受体介导的细胞内平行的信号通路与它们之间的网络关系
细胞可以适应刺激强度或刺激时间的变化,正是因为细胞可以校正对信号的敏感性。概括起来,靶细胞对信号分子的脱敏机制有如下5种方式:
(1)受体没收(receptorsequestration)细胞通过配体依赖性的受体介导的内吞作用(receptor-mediatedendocytosis)减少细胞表面可利用受体的数目,以网格蛋白/AP包被小泡形式摄入细胞,内吞泡脱包被形成无包被的早期内体,受体被暂时扣留,受pH降低的影响
(2)受体下调(receptordown-regulation)通过受体介导的内吞作用,受体-配体复合物转移至胞内溶酶体被消化降解而不能重新利用,因此细胞通过表面自由受体数目减少和配体的清除导致细胞对信号敏感性下调。受体-激素复合物的内吞作用和它们在溶酶体内被消化,是细胞表面减少RTK和细胞因子受体一种最基本的方式,从而降低细胞对胞外多肽类激素的敏感性。
(3)受体失活(receptorinactivation)如前所述,GRK使结合配体的受体丝氨酸/苏氨酸残基磷酸化,再通过与胞质抑制蛋白
(4)信号蛋白失活(inactivation of signaling protein)致使细胞对信号反应脱敏的原因不在于受体本身,而在于细胞内信号蛋白发生改变,如去磷酸化或者泛素化并降解,从而使信号级联反应受阻,不能诱导正常的细胞反应。
(5)抑制型蛋白质产生(productionofinhibitoryprotein)受体结合配体而被激活后,在下游反应中(如对基因表达的调控)产生抑制型蛋白质并形成负反馈环从而降低或阻断信号转导途径。
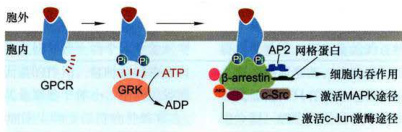
图11-41β-arrestin在GPCR脱敏和信号转导中的作用
GPCR在GRK作用下发生丝氨酸/苏氨酸残基磷酸化,为β-arrestin抑制蛋白的结合提供锚定位点,
思考题
1.何谓信号转导中的分子开关机制?请举例说明。
2.如何理解细胞信号系统及其功能?
3.试比较G蛋白偶联受体介导的信号通路(效应蛋白、第二信使、生物学功能)。
4.概述受体酪氨酸激酶介导的信号通路的组成、特点及其主要功能。
- 概述细胞表面受体的分类(配体、受体、信号转导机制)。
6.图解细胞表面受体调节基因表达的信号通路。
7.概述细胞信号的整合方式与控制机制。
参考文献
1.Cantley LC.The phosphoinositide 3-kinase pathway.Science,2002,296(5573):1655-1657.
2.Cheng H,Lederer WJ,Calcium sparks.PhysiologicalReviews,2008,88(4):1491-1545.
3.Cheng HLederer WJCannellMB.Calciumsparks:lemetaryeentsunderlyingexciaicotractioncouling in heartmuscle,Science,1993,262(5134):740-744.
4.GordonMssRWtnligtltleculeccsf BiologicalChemistry,2006,281:22429-22433.
5.HammHEHowactivatedreceptorscoupletoG-proteinsProceedingsoftheNationalAcademyofSciencesoftheUnited States ofAmerica,2001,98(9):4819-4821.
6.HeldinCLandstromMMoustakasAMchanismofGFβsignaling togrothaestapooisandielimesenchymal transition.CurrentOpinion in CellBiology,2009,21(2):166-176.
7.HubbardSRMillerWTReceptortyosinekinasesmechanismsofactiationandsignalingCurrentOpinioninCell Biology,2007,19(2):117-123.
8.ItohStenDkePegaivegulafβcpadglactCuenpiiCellogy00 19(2):176-184.
9.LeonardWRoleofJakkinasesandSATsincokinesignaltranductiInteationalounalofHematolog00 73(3):271-277.
10.PierceKLRizRJembneecsRevileclarCelgy0 3(9):639-652.
11.SoulardAallNigisiCelgy1(6):6
12.TaylorSSKiCVigilDetal.ymicsfsigligbyPKAocmicaetyicaAca(BBA)-od Proteomics,2005,1754(1-2):25-37.
13.YamYRBsuftdicac) 72-79.