4.线虫发育
导航
一、不变的细胞谱系
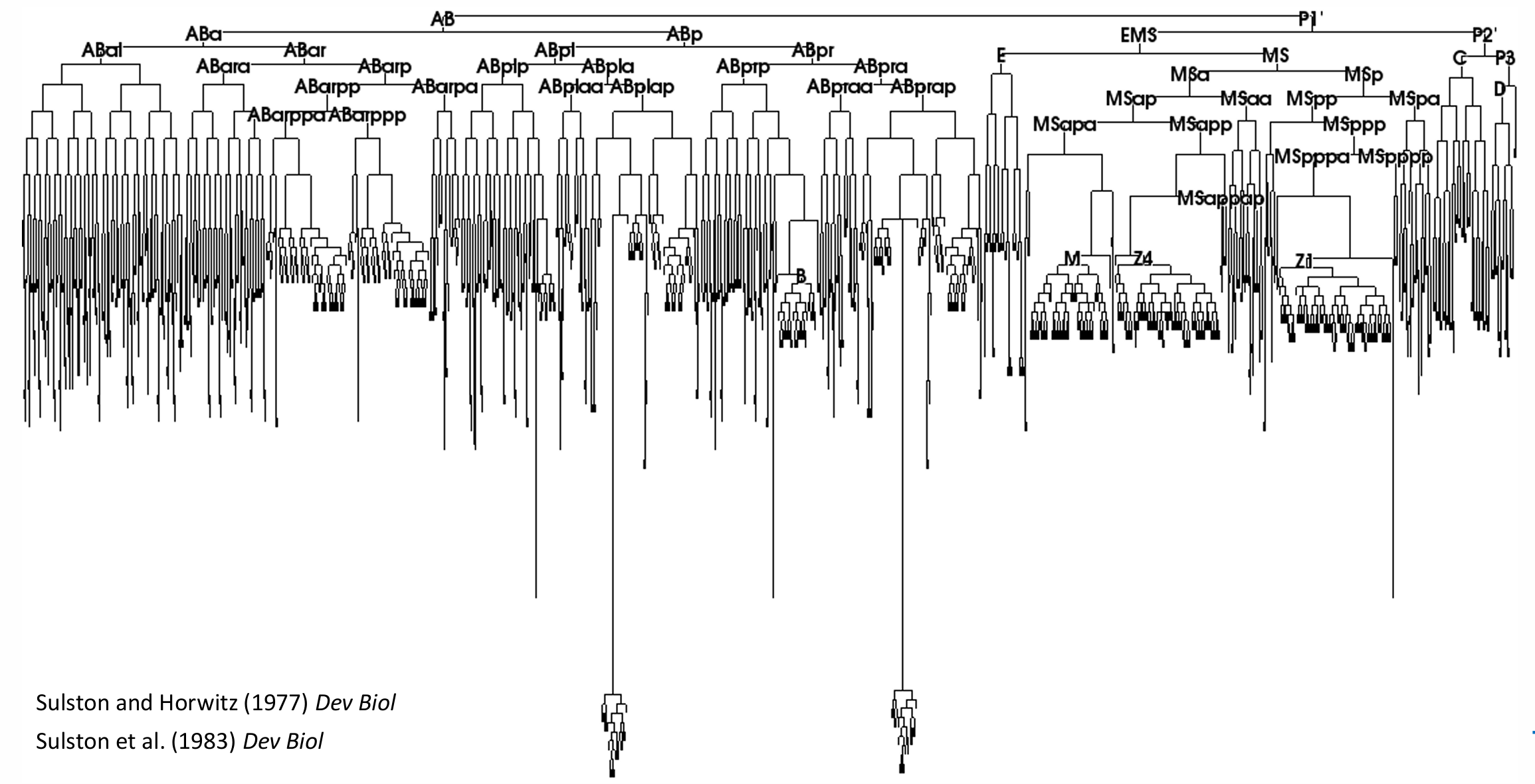
秀丽隐杆线虫不变的细胞谱系
秀丽隐杆线虫具有恒定细胞谱系(invariant cell lineage),这意味着在所有的胚胎中,每个细胞所产生的细胞数量和类型都是相同的。这能使人们了解哪些细胞具有相同的祖细胞。因此,对于每个胚胎中的细胞,我 们都可以知道它来自哪里(也就是在早期胚胎中哪个细胞是它的祖细胞),以及将来形成哪种组织。此外, 与脊椎动物的细胞谱系不同,秀丽隐杆线虫的谱系从一个个体到另一个个体几乎完全不变,几乎没有随机性。
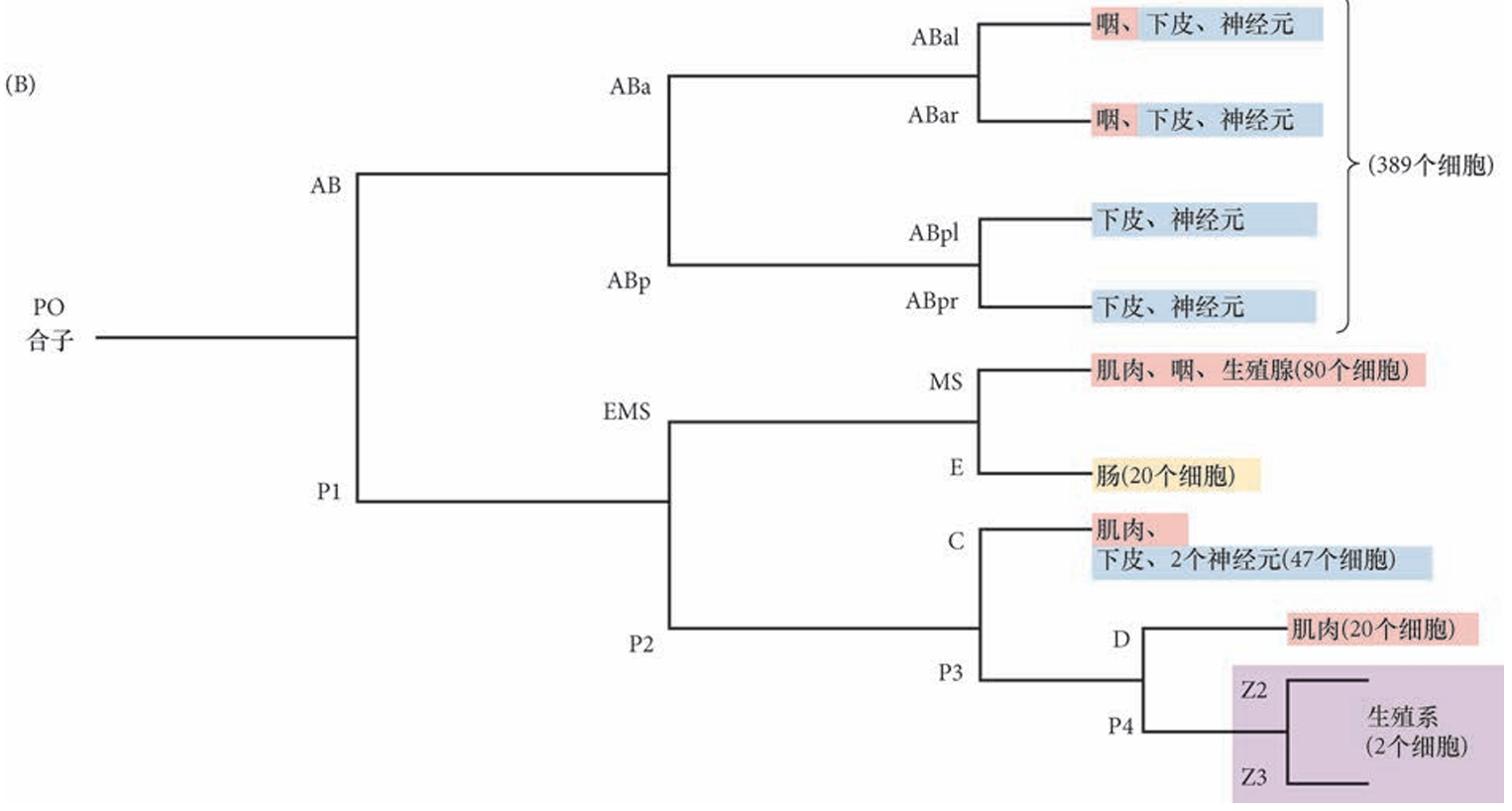
简略细胞谱系图。生殖系分离到最后端细胞(P)的后部分。最初的三次细胞分裂产生AB、 C、MS和E谱系。括号内的细胞数代表新孵化幼体中的558个细胞,其中一些细胞继续分裂以产生成体的959个细胞
秀丽隐杆线虫的基因组是第一个从多细胞生物体中获得的完整序列(C. elegans Sequencing Consortium 1999)。尽管它的基因数量与人类大致相同(线虫有18 000 ~20 000 个基因,人类有20 000~25 000个基因),但线虫基因组中碱基的数量大约仅是人类的3%。
秀丽隐杆线虫具备几乎所有主要躯体结构体系的原基(摄食、神经、繁殖等,尽管它不具有骨骼, 并且它在死亡之前显现出衰老的表型。神经生物学家因为秀丽隐杆线虫仅有一个极小的神经系统(302 个神经元)而感到振奋,并且所有7600个突触(神经元的连接结构)都被已被鉴别出来。此外,秀丽隐杆线虫对分子生物学家尤为方便。注射进线虫细胞的DNA很容易与细胞核整合,而且线虫可以从其培养基中摄取反义RNA。
二、线虫的受精
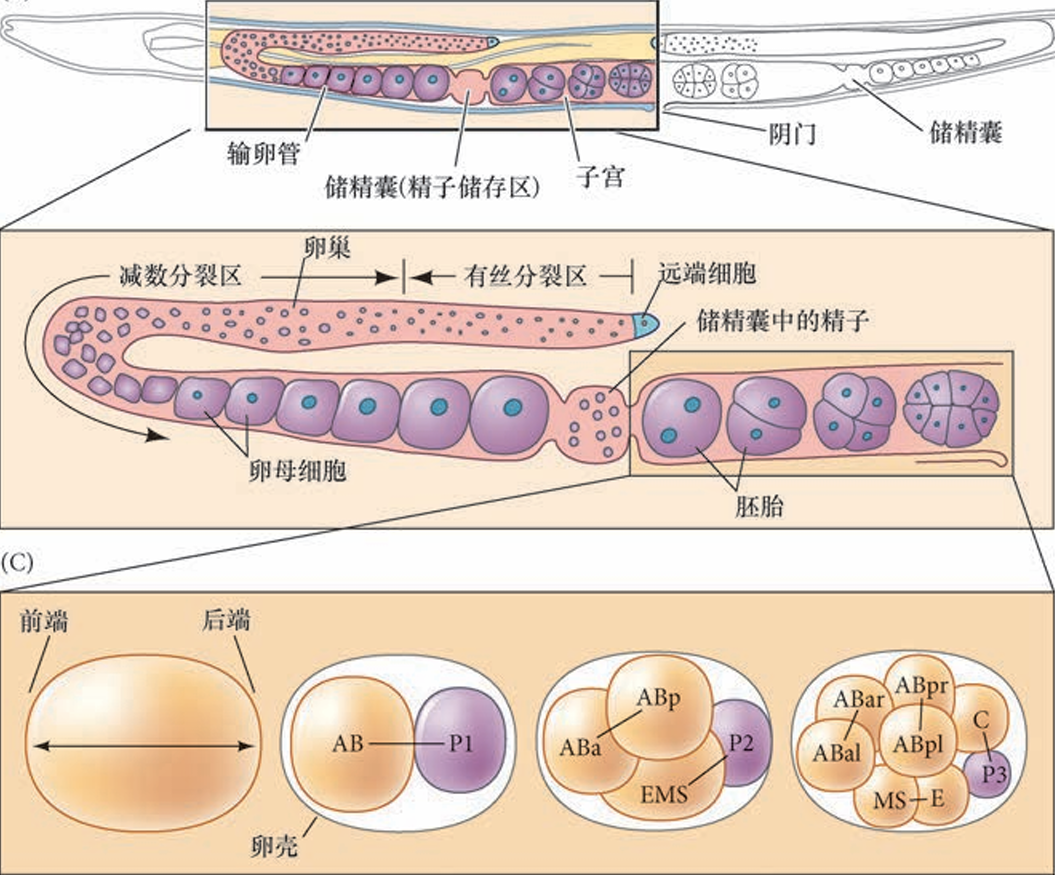
大部分秀丽隐杆线虫个体为雌雄同体,能同时产生精子和卵子,因此在同一个成体内便可发生受精。当卵子滚动经过含有成熟精子的储精囊时就会被受精。精子并不是典型的长尾和流线型细胞,而是小、圆和无鞭毛的细胞,它们以变形虫状的运动缓慢行进。当精子与卵细胞膜融合时,新形成的受精卵迅速合成几丁质(组成外皮的蛋白质) 以防止多精入卵。而后,受精卵进行早期卵裂,从阴门排出。
三、旋转卵裂与胚轴形成
秀丽隐杆线虫的合子呈现旋转完全卵裂。在早期卵裂过程中,每一次不对称分裂都产生 一个生成细胞(标记为AB、E、MS、C和D)和一个干细胞(P1~P4谱系),生成细胞能产生分化的子代细胞。前-后轴在第一次卵裂之前就已经被决定。卵裂沟以不对称的方式沿着卵的这一轴向形成,靠近 将来成为后极的位置。第一次卵裂形成一个前部的生成细胞(AB)和一个后部的干细胞(P1)。背-腹轴 由第二次卵裂决定。生成细胞(AB)沿赤道面(纵向,与前-后轴成90°角)分裂,而P1细胞沿子午面 ( 横向)分裂,产生另一个生成细胞(EMS)和一个后部干细胞(P2)。EMS标志发育中胚胎的腹部。干细 胞谱系总是沿子午面分裂,以产生一个前部的生成细胞和一个维持干细胞谱系的后部细胞。在4细胞期 到8细胞转换时,可以观察到左-右轴。在这里,AB细胞的两个“孙代”细胞(ABal和ABpl)在左侧, 而另外两个(ABar和ABpr)在右侧。
三、第一次卵裂
第一次卵裂与前后轴的建立
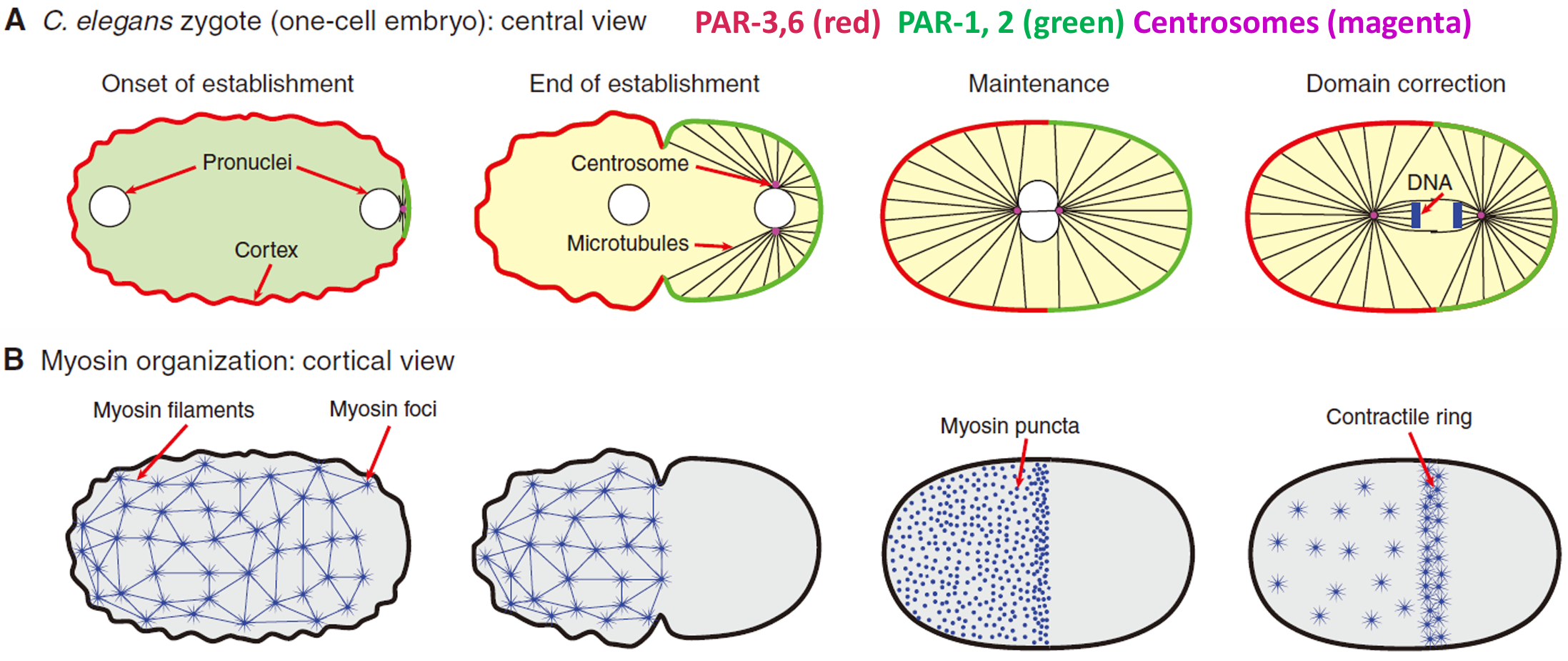
未受精卵不存在极性,但精子进入后会控制第一次裂解。 精子中心体和肌动蛋白网络之间的相互作用引发不对称收缩。
- 皮质成分流向未来 A 端
- 细胞质成分流向未来的 P 端
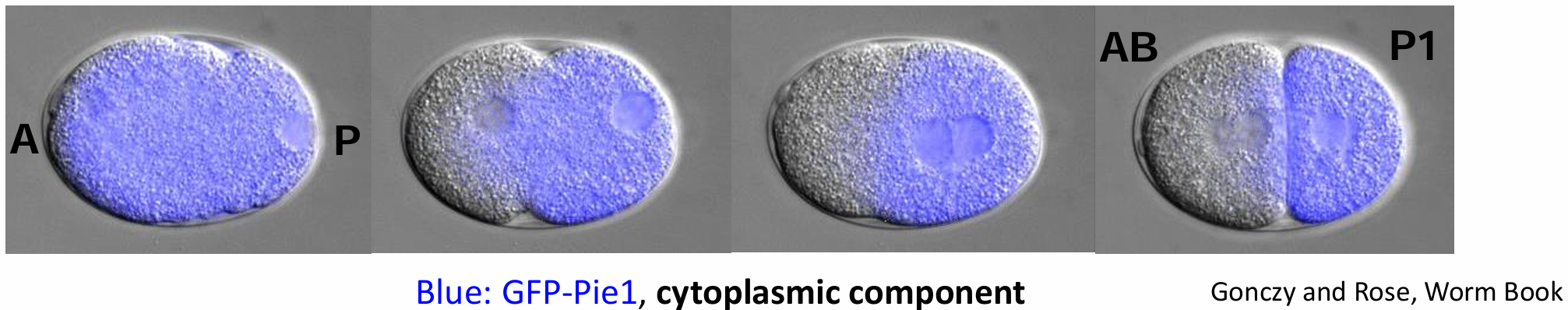
蓝色荧光蛋白标识了细胞质成分
卵的哪一端将成为前部、哪一端将成为后部似乎取决于精原核的位置。当精原核进入 卵母细胞的细胞质时,卵母细胞并不具备极性。然而,在卵母细胞的细胞质中,一些分隔缺陷蛋白 (partitioning-defective) 却具有特定的空间分布。
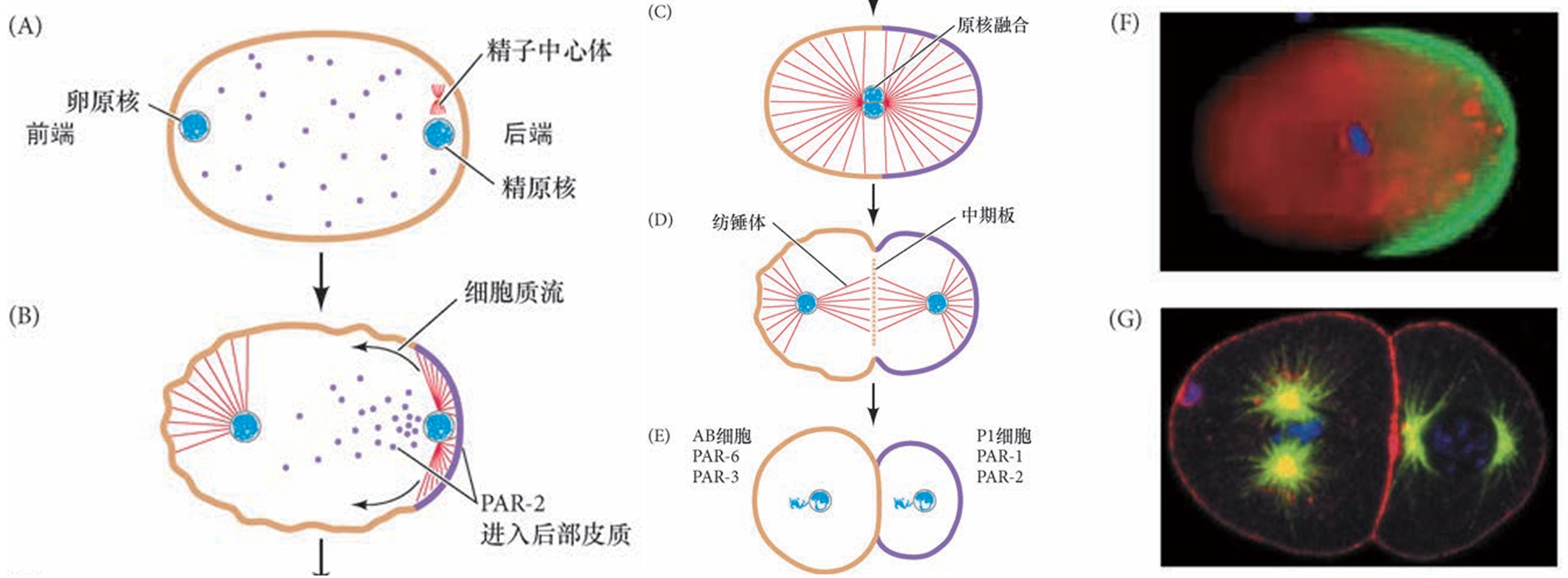
(A)精子入卵后,卵细 胞核进行减数分裂(左)。皮质细胞质(橙色)含有PAR-3、PAR-6和 蛋白激酶-3,内部细胞质含有PAR-2和PAR-1(紫色圆点)。
(B,C)精 子中心体的微管启动肌动蛋白组成的细胞骨架向胚胎的未来前端收缩。 这些精子微管也保护PAR-2蛋白不被磷酸化,使它能够与其结合蛋白 PAR-1 一起进入皮质。PAR-1使PAR-3磷酸化后,PAR-3及其结合蛋白 PAR-6 和蛋白激酶-3一起脱离皮质。
(D)细胞的后部由PAR-2和PAR-1 决定,而前部由PAR-6和PAR-3决定。因为微管更靠近后极,因而在 分裂中期,中期板并不不对称。
(E)中期板将合子一分为二,一部分具 有前端的PAR 蛋白,另一部分具有后端的PAR蛋白。
(F)在这个正在卵裂的秀丽隐杆线虫的合子中,PAR-2蛋白被染成绿色,DNA被染成蓝色。
(G)在第二次卵裂时,AB细胞和P1细胞的分裂面互相垂直(彼此呈90°角)
PAR-3和PAR-6与蛋白激酶-3(其突变导致分隔缺陷)相互作用,它们均匀地分布在皮质细胞质。蛋白激酶- 3 使PAR-1和PAR-2磷酸化而将它们限制在内部的细胞质。精子的中心体通过其微管与皮质细胞质接触而起始细胞质的运动,将雄原核推向椭圆形卵母细胞的最近端,这一端将成为后极 。不仅如此,这些微管区域性地保护PAR-2,使其不被磷酸化,从而使PAR-2 ( 及其结合蛋白PAR-1)进入最靠近中心体的皮质。一旦PAR-1定位于皮质细胞质,它使PAR-3磷酸化, 导致PAR-3(及其相结合的蛋白激酶-3)离开皮质。同时,精子微管诱导肌动蛋白-肌球蛋白组成的细胞骨架向前部收缩,进而将PAR-3、PAR-6和蛋白激酶-3从1细胞期胚胎的后部去除。在第一次卵裂期间, 中期板更靠近后部,受精卵分裂成两个细胞,一个含有前部PAR蛋白PAR-6和PAR-3,另一个则含有后部PAR 蛋白PAR-2和PAR-1。(下图右)
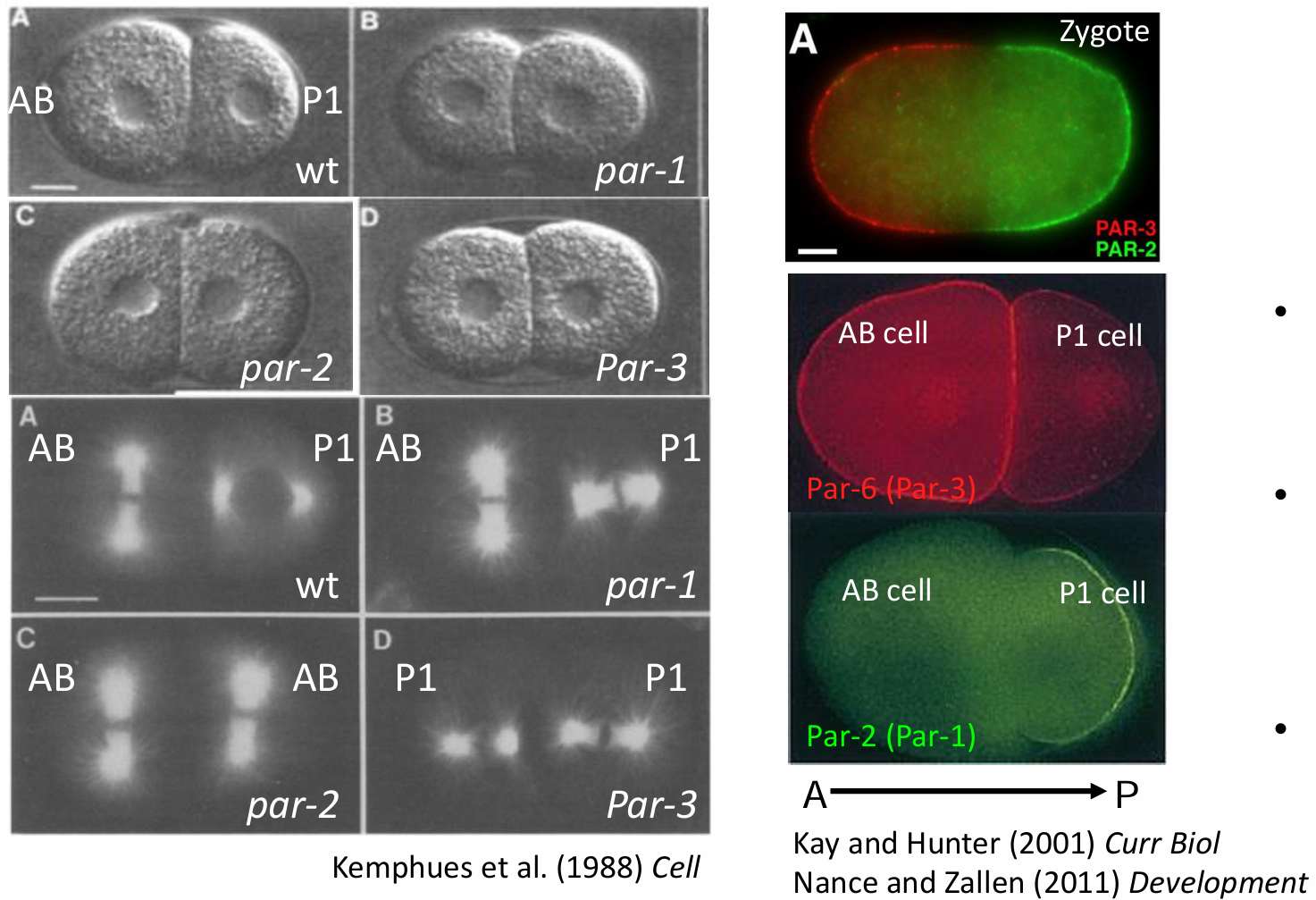
母体效应基因par(partition defective)突变体 ; 不同的par蛋白随第一次卵裂的分布
Par蛋白的保守性与多样化作用
PAR 蛋白最先因为不同母体效应基因突变体发现于秀丽隐杆线虫(上图左),识别出来了par1,2,3,4。同时,许多其他动物也利用PAR蛋白建立细胞极性。在果蝇(Drosophila),它们对卵母细胞前部和后部区域的形成起至关重要的作用,并且参与区分果蝇上皮细胞的基端和顶端。果蝇中PAR蛋白的重要作用还表现在它们决定神经干 细胞分裂后的子细胞中哪一个成为神经元,哪一个仍然是神经干细胞。在哺乳动物,PAR-1的同源蛋白对神经细胞的极性也起关键作用。

线虫和果蝇中的par蛋白 ;
母体 PAR 蛋白的正确定位确立了 A-P 轴
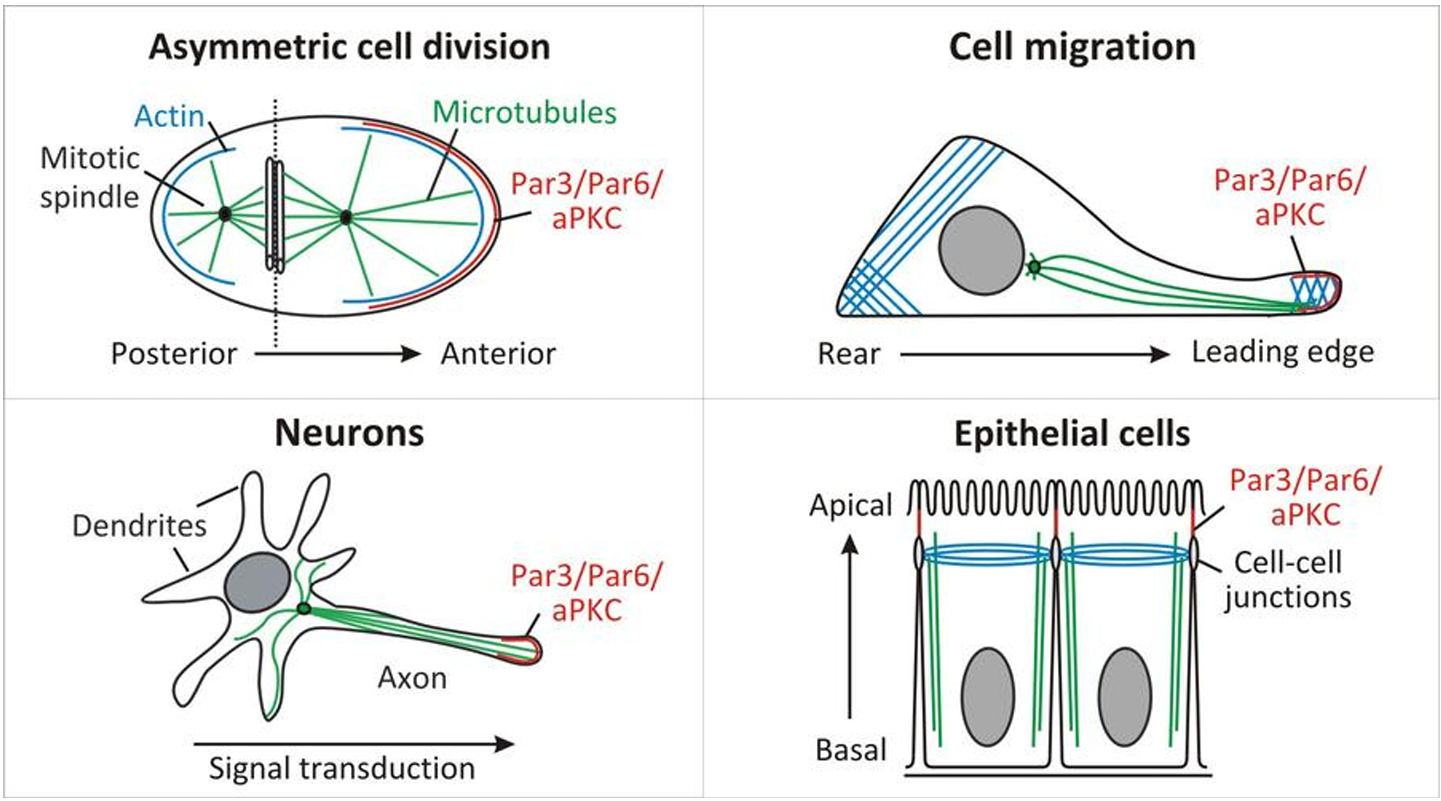
从线虫到果蝇再到脊椎动物,PAR 蛋白都是保守的,参与了许多组织中细胞极性的建立和维持。
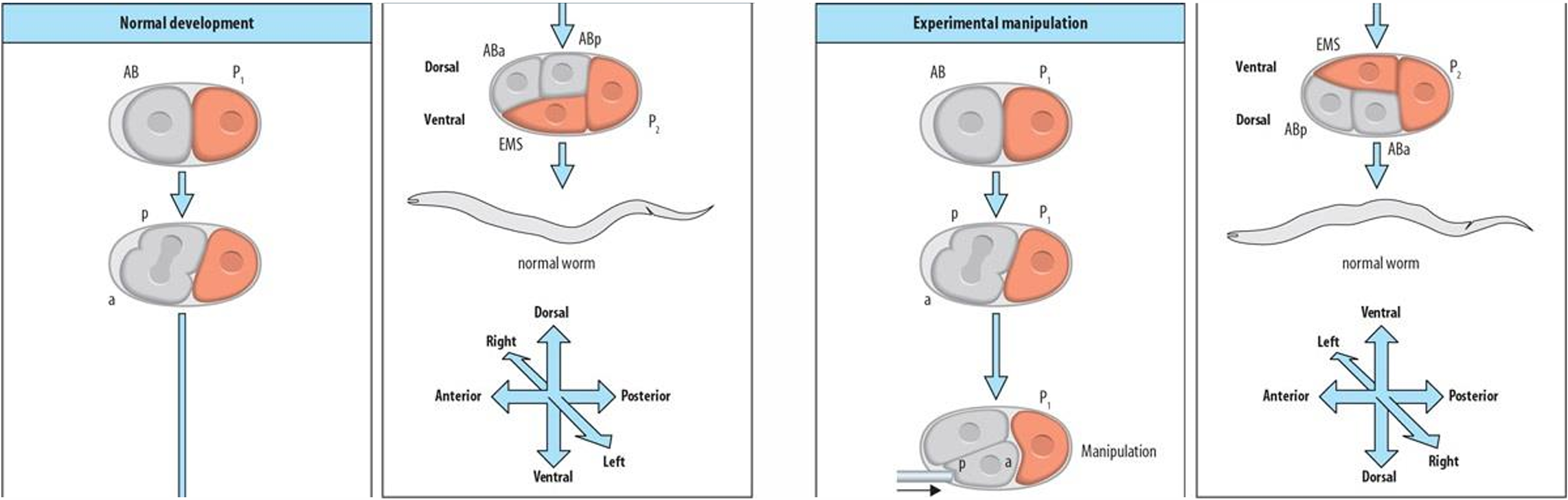
四、第二次卵裂与背腹轴的建立
秀丽隐杆线虫的背-腹轴是在AB细胞的分裂中建立的 在分裂时,这个细胞的长度变得比卵壳的宽 度还要大,这种情形造成的挤压导致子细胞滑动,一个靠近前端,另一个靠近后端(分别被称为ABa和ABp细胞)。这种挤压也导致ABp细胞处于P1卵裂球分裂形成的EMS细胞上方的位置。因此,ABp细胞标志胚胎的未来背部,而EMS细胞(即肌肉和肠细胞的前体)则是胚胎未来腹部的标志。
ABa 和 ABpc 细胞最初是等价的,与相邻细胞的相互作用是确定不同细胞命运的关键;ABpcell 由相邻 P2 单元的信号指定
P2 细胞产生的 APX-1(Delta-like)是 ABp 细胞中 GLP-1(Notch-like)的激活配体。 GLP-1RNA 在所有细胞中都会产生,但在 P 细胞系中其翻译会受到 POS-1 的抑制。
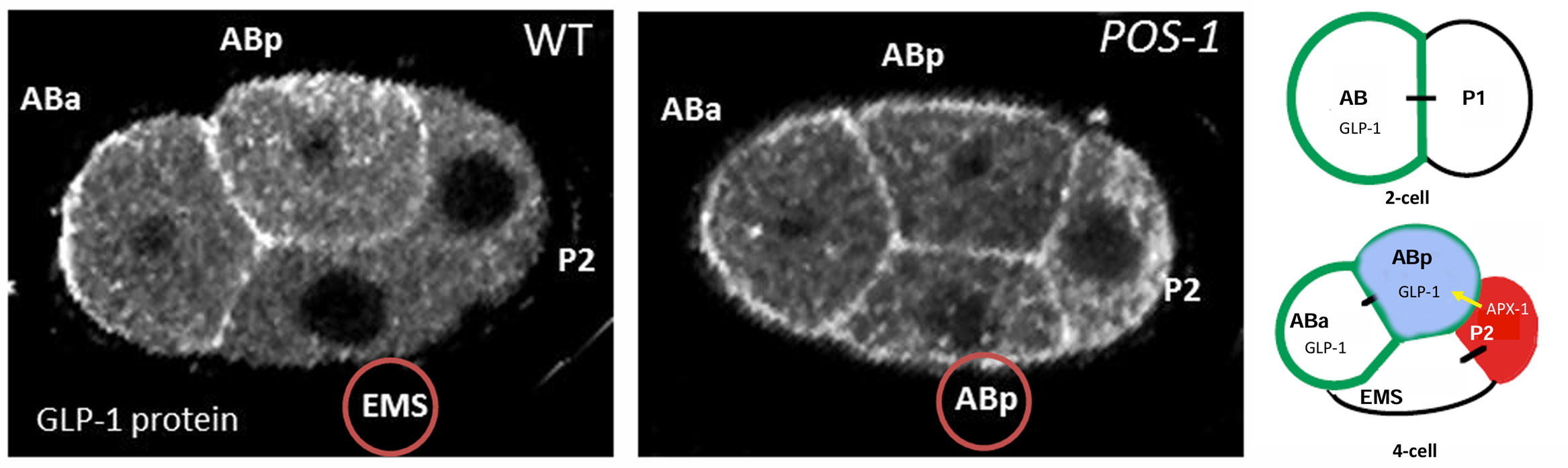
GLP-1蛋白的表达定位 :左图是野生型,右图是POS-1突变型 ;GLP-1与APX-1的相互作用
五、第三次卵裂与左右轴的建立
左-右轴在12细胞期之前并不明显。这时,MS卵裂球(从EMS细胞分裂而来)与ABa细胞的一 半“孙女”相接触,将躯体的左右两侧区分开来。这一不对称的信号为其他一些区分 幼体左右两侧的诱导事件做好了准备。的确,位于线虫脑左右两侧的各种神经元的命运都可以追溯到12细胞期发生的这种变化。
尽管在12细胞期可以很容易地观察到左右不对称,然而左右不对称的第一个标示可能出现在合子期。在第一次卵裂之前,胚胎在卵 黄被内部旋转120°。相对于已经建立的前-后轴,胚胎总是向同一方向旋转,这表明胚胎已经具有左右不对称性。如果细胞骨架蛋白或者PAR蛋白受到抑制,那么旋转的方向及随后的手性就会变成随机的事件。
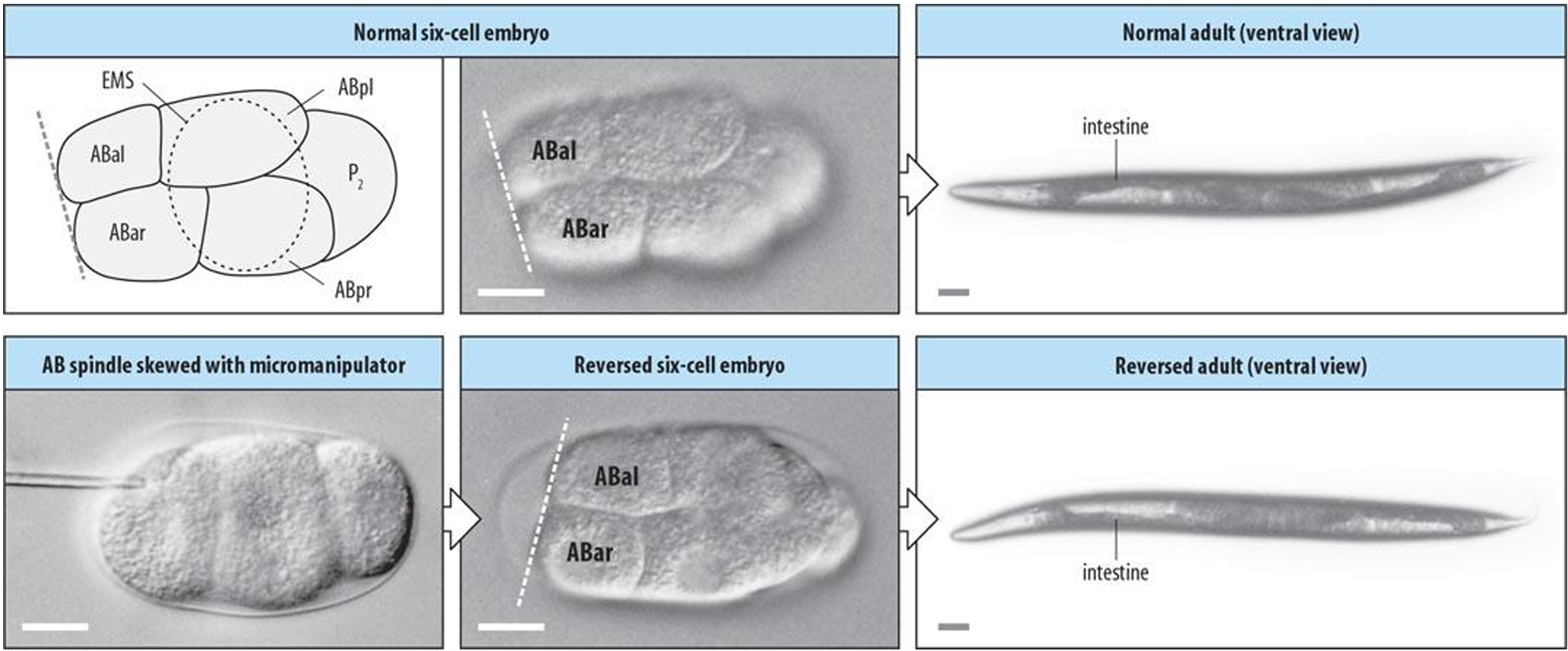
AB 分为 ABal(稍前的细胞)和 ABar。将 ABar 推向前侧足以扭转动物的手性
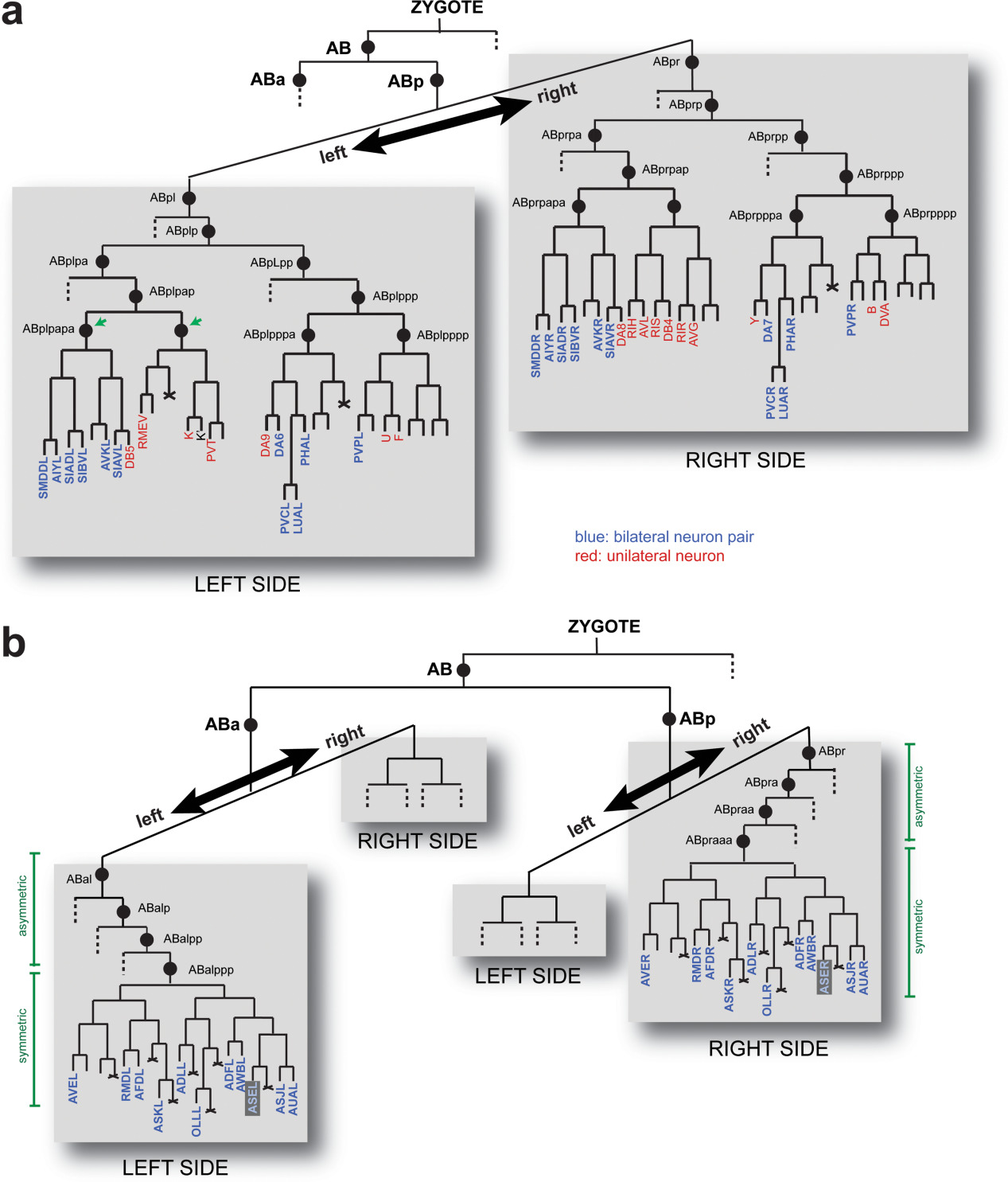
系谱历史和神经元对称性。 "a/p/l/r "表示沿前/后/左/右轴的分裂。
(a) 具有两侧对称历史的品系分支示例,这些分支来自 ABp 胚泡横跨左/右轴的早期分裂。 这两个分支包含两侧对称的神经元对(蓝色表示),但也包含单侧神经元(3 或 4 字母代码)或单侧神经母细胞(胚后分裂;单字母代码)(红色表示)。 绿色小箭头表示这些胚泡接受 Notch 信号,Notch 信号可能参与了这些品系分支内不对称的产生(见正文)。
(b) 产生两侧对称神经元但来源于不同胚泡的系支,在胃形成后才开始共享两侧对称的裂解模式。 此处显示的分支包含 11 对神经元,占不共享两侧对称谱系历史的 40 对神经元的四分之一强(这 40 对神经元列于佐证资料表 S2)。 ASE 神经元对以灰色阴影显示。
六、卵裂球特征的控制
秀丽隐杆线虫同时表现出条件性和自主性的细胞特化 如果将最早两个卵裂球用实验方法分开,就 都可以观察到这两种特化方式。在没有AB细胞的情况下,P1细胞能够自主发育,产生它在正常情况下所产生的所有细胞,结果是形成了胚胎的后半部分。然而,分离的AB细胞仅能产生它在正常情况下所能产生的那些细胞的很小一部分。例如,通过分裂产生的ABa细胞就无法形成它在正常胚胎中应该形成的咽部肌肉。因此,AB卵裂球的特化是条件性的,它需要与P1的后代细胞相互作用才能正常发育。
自主性特化
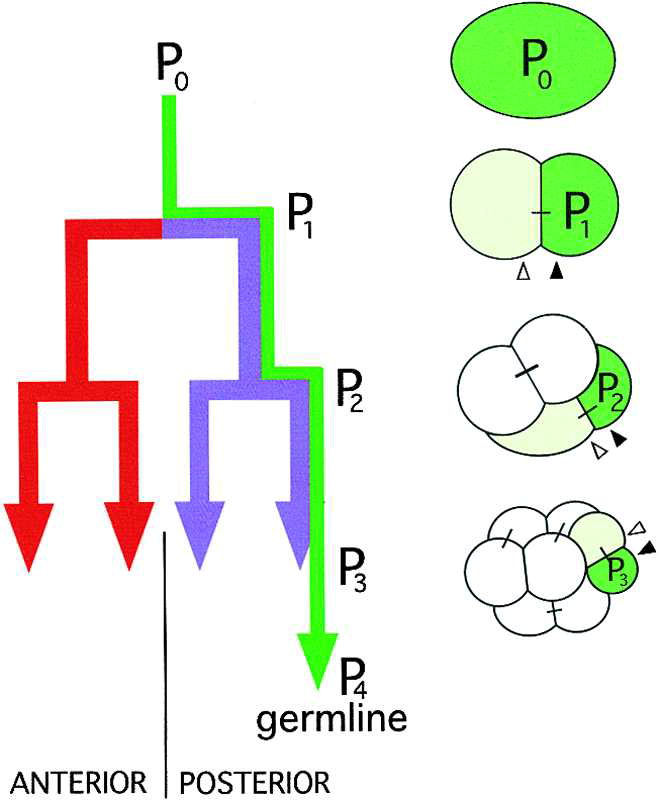
左图显示了前几个胚胎分裂的谱系图。表达anterior蛋白的谱系分支以红色显示,posterior蛋白以紫色显示,germline蛋白以绿色显示。种系分支中的连续卵裂球被命名为 P0 (1 细胞胚胎)、P1 、 P2 、 P3 和 P4 。
早期卵裂球的示意图如右图所示。每个种系卵裂球都是绿色的,它的体细胞姐妹是浅绿色的。为了与后来的数字进行比较,种系和体细胞姐妹用箭头表示。在 4 细胞阶段开始时,两个前部(白色)胚泡中的一个被周围的卵壳挤向后部。 这一运动导致两个前胚泡和两个后胚泡形成如图所示的斜方体结构。
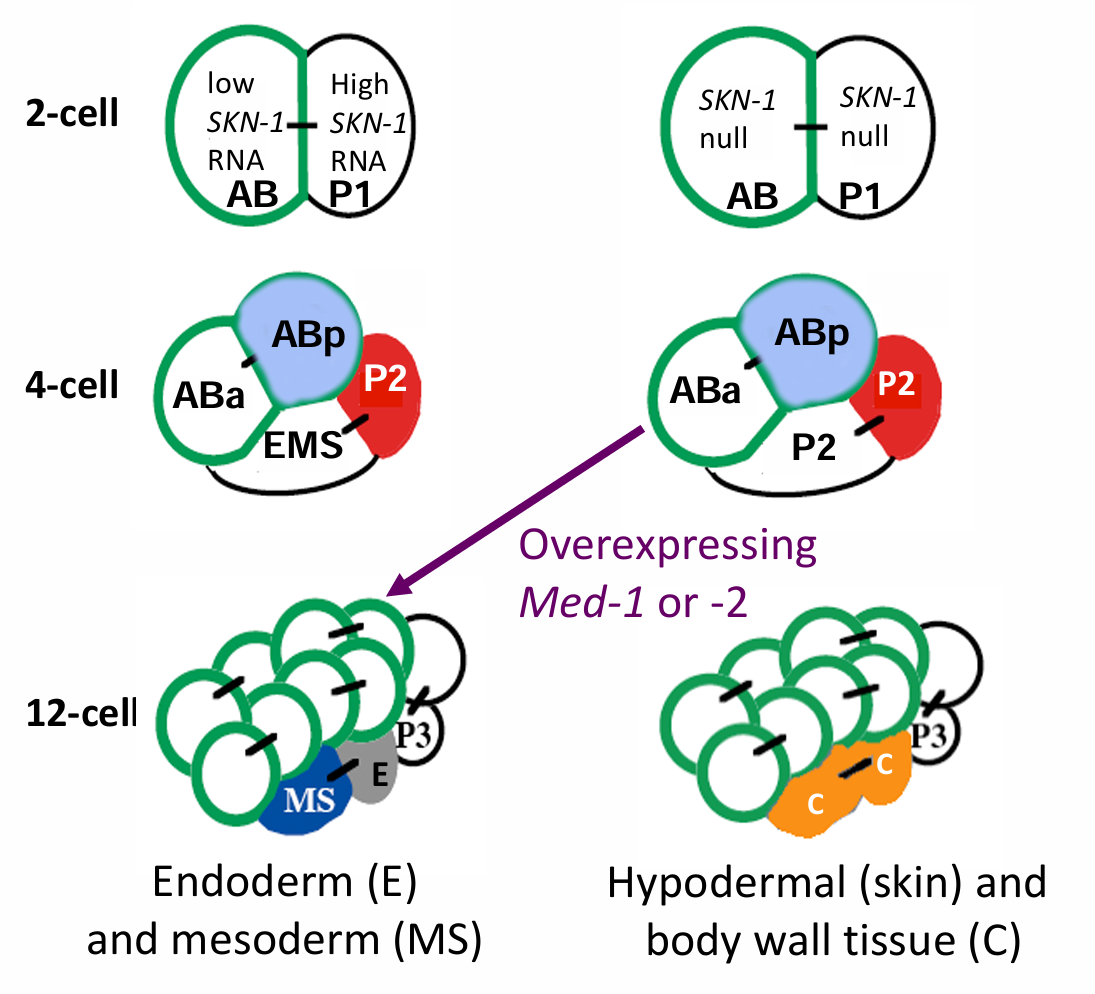
P1细胞产生4个生成细胞(MS、E、C和D细胞), SKN-1、PAL-1 和PIE-1 等内源转录因子决定了这4个细胞所产生的那些细胞的命运。
SKN-1 蛋白控制产生咽后部细胞的EMS卵裂球的命运。在第一次卵裂之后,只有后部的卵裂球,也就是P1卵裂球,具有在分离的情况下产生咽部细胞的能力。在P1分裂之后,只有EMS能够在分离的情况下产生咽部肌肉细胞。类似地,EMS细胞分裂后, 其子代细胞中只有一个细胞,即MS细胞,具有产生咽部组织的内在能力。这些发现暗示,咽部细胞的命运可能是由细胞质中的母体因子决定的,它们在分裂过程中被分配到这些特定的细胞。
SKN-1是一个转录因子,参与启动形成咽和肠的一些基因的激活。来自skn-1纯合突变体母本的胚胎没有源自EMS的咽中胚层和内胚层衍生组织,在应该形成肠和咽的部位形成了额外的皮下(皮肤)和体壁组织,而没有形成正常的肠和咽部结构。换句话说,EMS细胞似乎被特化成C细胞。只有注定形成咽或肠的细胞才会受到这一突变的影响。
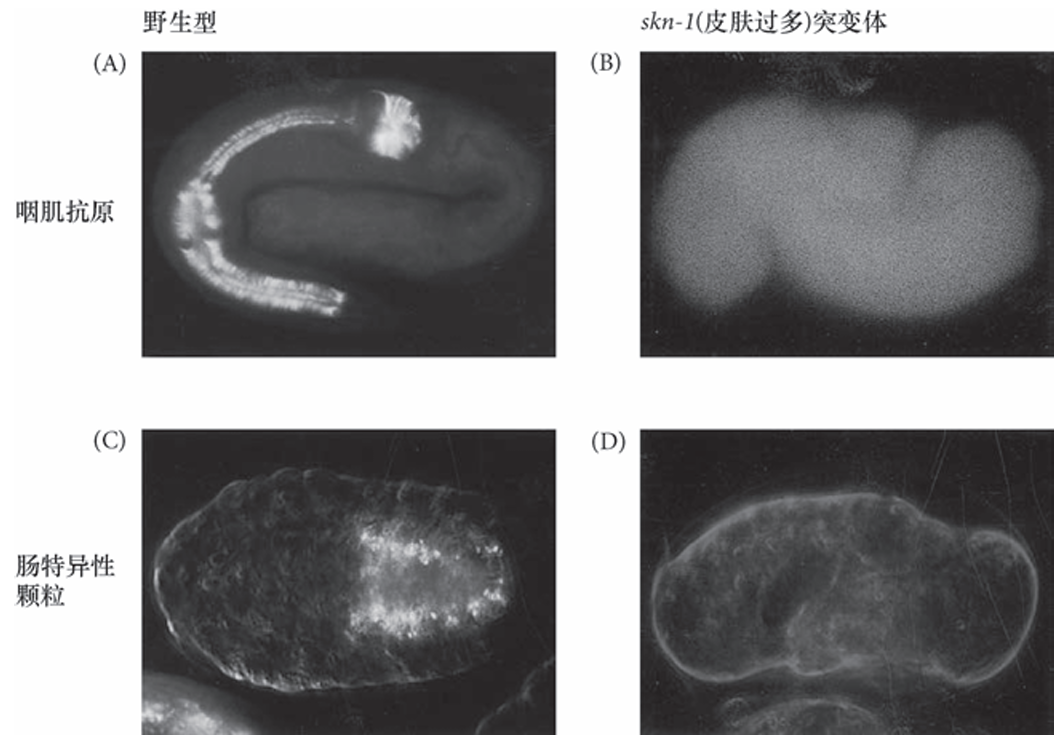
秀丽隐杆线虫的skn-1突变体中缺失肠和咽。在野生型胚胎(A, C) 和skn-1 纯合突变体胚胎(B,D) 中检测咽肌(A,B)和肠特异性颗粒 (C,D)。一个咽肌特异性抗体能标记 野生型胚胎中的咽部肌肉组织(A), 但不能标记skn-1突变体胚胎中的任何组织结构(B)。类似地,(C)代表胚胎肠特征的肠颗粒在(D)skn-1突变体胚胎的肠中缺失
PAL-1参与P1谱系的分化,其活性对P2卵裂球的体细胞(而非生殖系细胞) 后代的正常发育是必要的,而P2卵裂球特化肌肉的形成。缺少PAL-1的胚胎没有源自C和D干细胞的 体细胞类型。PAL-1 受 MEX-3 蛋白的调节,后者是一个RNA结合蛋白,对 pal-1 的翻译具有抑制作用。在任何表达MEX-3的位 置,PAL-1就会缺失。因此,在缺失mex-3的突变体 中,每个卵裂球都会表达PAL-1。SKN-1也可以抑制 PAL-1( 由此在EMS细胞中阻止其活性)。在生殖系中,PUF-8蛋白与pal-1 的mRNA的3′端非翻译区(UTR)相结合,从而阻止 PAL-1 的合成。
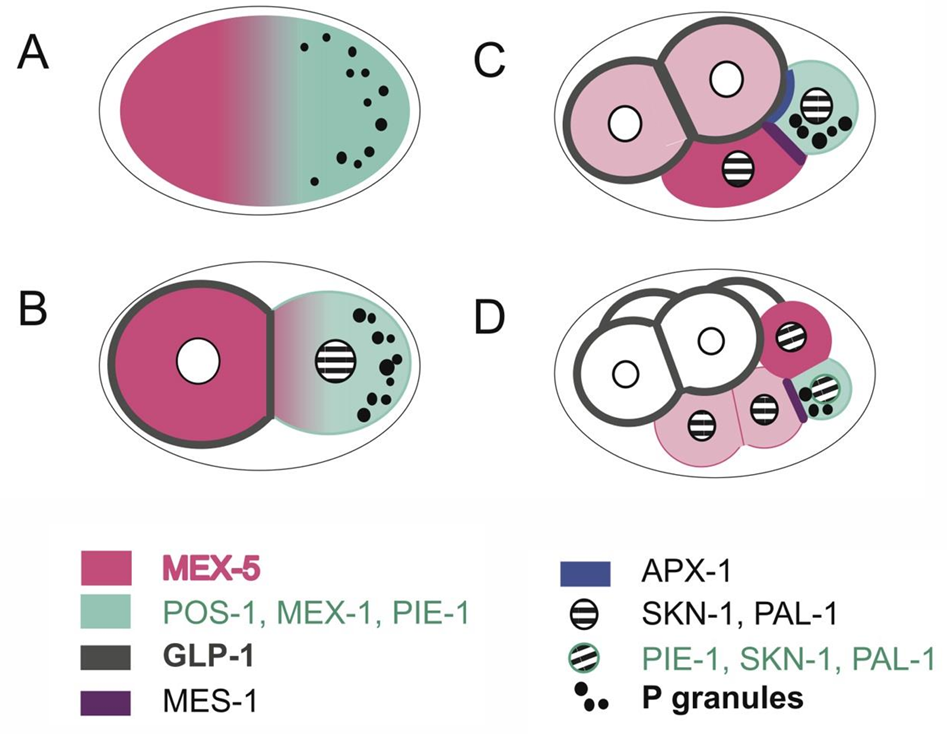
PIE-1对生殖细胞的命运是必要的,其在PAR-1蛋白的作用下被置入P卵裂球,而且它可以在P2及随后的生殖系细胞中抑制SKN-1和PAL-1的功能。母体pie-1 基因的突变导致生殖系卵裂球获得体细胞的命运,使得P2细胞具有与野生型EMS卵裂球相似的行为。PIE-1 决定物在2细胞期被分隔至P1卵裂球。 精子中心体在卵的后部抑制PAR-3/PAR-6复合体的形 成。这使PAR-2和PAR-1发挥功能,进而抑制可以降 解PIE-1 的 MEX-5 和 MEX-6 蛋白。所以,PIE-1在前部的AB细胞中被降解,但在P1细胞中得以保存。PIE-1的定位及其遗传学特性暗示它抑制体细胞命运的建立,并维持生殖细胞谱系的全能性。
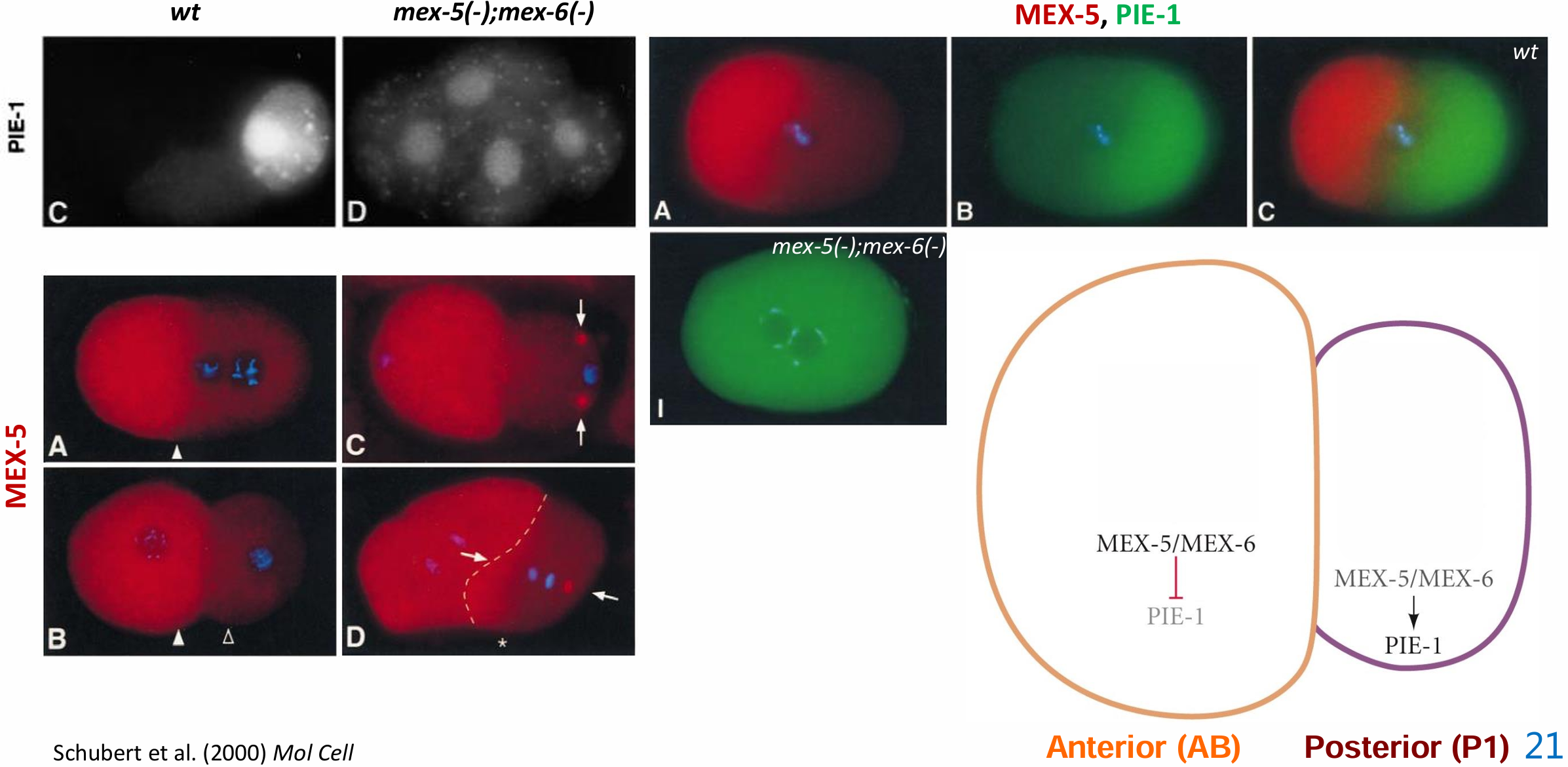
左上图:野生型和mex-5/mex-6突变型胚胎中PIE-1蛋白定位
右上图:(A-C)对 (A) MEX-5 和 (B) PIE-1 进行免疫染色的单个野生型单细胞胚胎;合并后的图像如 (C)所示。
左下图:(A)单细胞阶段。雄性和雌性原核尚未融合形成合子核。箭头标记了 MEX-5 的高前水平和低后水平之间的过渡。(B) 双细胞阶段。(C) 晚期 2 细胞期。新生有丝分裂纺锤体的方向由箭头指示;注意两个中心体上的 MEX-5。(D) 分裂时的双细胞期。种系卵裂球中的纺锤体轴(虚线右侧)已旋转(箭头)。MEX-5 在后中心体上以高水平存在。注意细胞前部的 MEX-5(星号)。
条件性特化
内胚层细胞谱系的发育中可见到条件性特化。在4细胞期,EMS细胞需要来自邻近(也是姊妹)的细胞, 即P2卵裂球的信号。通常,EMS细胞分裂成一个MS细胞(产生中胚层的肌细胞)和一个E细胞(产生肠内胚层)。如果在4细胞期的早期去除P2细胞,那么EMS细胞将分裂成两个MS细胞,因此不会产生内胚层。然而,将EMS细胞与P2卵裂球重新组合在一起后就会形成内胚层。但是,如果与ABa、 ABp分别组合或与这两个AB的衍生细胞共同组合在一起,就不会有内胚层的形成。
MS 细胞的特化起始于母体的SKN-1对一些转录因子基因的激活,如MED-1和MED-2。POP-1信号(编码结合β-联蛋白到DNA的TCF蛋白)通过阻断MED-1和MED-2,使它们不能激活一些内胚层的转录因子(比如END-1),从而阻断未来MS细胞中E细胞(内胚层)命运的途径,使这些细胞变成MS细胞。
MED-1,2不能激活其他转录因子,只能激活tbx-35。转录因子TBX-35在 MS细胞中激活中胚层基因,包括咽谱系的pha-4基因,以及肌肉中的hlh-1(编码一个肌源性转录因子)。TBX-35同时也抑制pal-1 基因的表达,由此抑制MS细胞获得C卵裂球的命运。在整个动物界,TBX蛋白在中胚层的形成过程中都具有重要作用。TBX-35在线虫的咽和肌肉中分别激活中胚层基因pha-4和hlh-1。
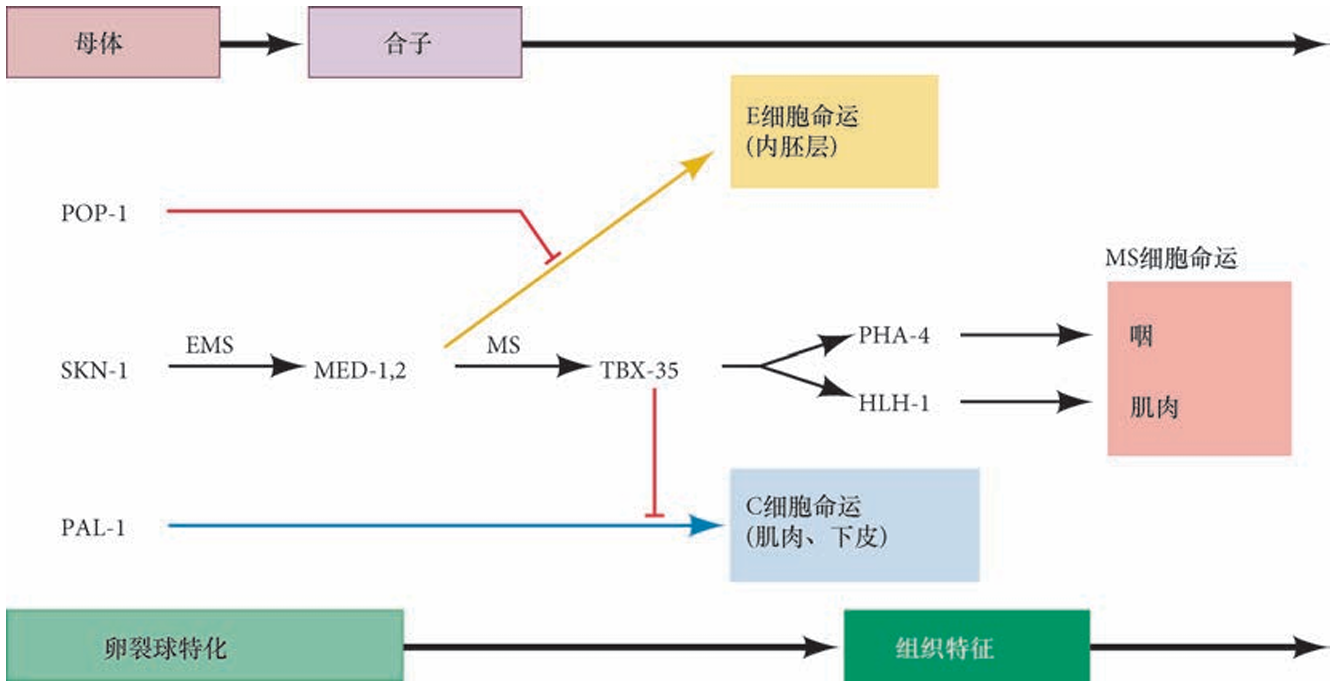
MS卵裂球特化的模式图。在EMS细胞中,母体的SKN-1激活GATA 家族转录因子MED-1和MED-2。POP-1信号抑制这些蛋白质,
P2 细胞通过Wnt信号转导信号指令与之相邻的一个EMS子细胞变成E细胞。P2 细胞产生MOM-2(线虫Wnt蛋白),该MOM-2信号在EMS细胞中被MOM-5(线虫版的Wnt受体蛋白Frizzled)接收。这一信号转导级联的结果是在注定变成E细胞的EMS子细胞中下调pop-1基因的表达。在缺失pop-1的胚胎中,两个EMS子细胞都变成E细胞。因此,Wnt 信号途径对线虫前-后轴的建立有关键的作用。值得注意的是,如我们将要看到的 那样,Wnt信号途径在整个动物界都参与前-后轴的特化。
P2 细胞也产生一个关键信号,将ABp与其姊妹细胞ABa区分开来。ABa细胞产生神经元、下皮及前部咽细胞,而ABp仅产生神经元和下皮细胞。如果用实验手段将这两个细胞的位置相互交换,那么它们的命运也会发生反转,从而形成一个正常的胚胎,即ABa和ABp是对等细胞, 它们的命运取决于它们在胚胎中的位置。细胞移植和遗传学实验证明,ABp因为与P2细胞的相互作用而变得与ABa细胞不同。在未受干扰的胚胎中,ABa和ABp都与EMS卵裂球相接触,但只有ABp与P2细胞接触。如果在早期的4 细胞胚胎中去除P2细胞,那么ABp细胞就不能产 生它的正常细胞子代。 ABp 与P2之间的接触对于ABp细胞的命运特化是必不可少的。如果强制性地使ABa细胞与P2细胞相接触,那么ABa就会被转变成ABp类型的细胞 。
这一相互作用受ABp细胞表面的GLP-1蛋白和P2卵裂球的APX-1(anterior pharynx excess)蛋白所介导。在母本具有glp-1突变的胚胎 中,ABp转变成一个ABa细胞。GLP-1 是一个高度保守的 Notch 蛋白家族成员,在许多细胞与细胞的相互作 用中发挥细胞膜受体的功能。ABa和ABp细胞的表面都表达GLP-1(Evans et al. 1994)3。一些Notch 蛋白(如GLP-1)的一个最重要的配体是细胞表面蛋 白Delta。在线虫中,与Delta类似的蛋白质是P2 细胞表达的APX-1(Mango et al. 1994a;Mello et al. 1994)。因为APX-1仅在与之接触的AB子细胞(也 就是ABp卵裂球)中激活GLP-1蛋白,所以APX-1 信号打破了ABa和ABp之间的对称性。这样,P2 细胞就能建立线虫的背-腹轴,并且使ABp细胞具有与其姊妹细胞不同的命运。
自主性与条件性特化的整合:线虫咽部的分化
如前所述,咽是来自两组细胞。 一组是来自EMS细胞的咽前体细胞,依赖于母体skn-1基因。另一组咽前体细胞来自ABa卵裂球,依赖于源自EMS细胞的GLP-1信号途径。在这两种情况下,咽前体细胞都受到指令而激活pha-4基因 。pha-4 基因编码一个与哺乳动物HNF3β(肝细胞核因子)相似的转录因子。
Gaudet 和Mango(2002) 利用微阵列研究显示,PHA-4转录因子激活几乎所有咽特异的基因。PHA-4转录因子似 乎是一些母体信号输入的节点,并且能将它们转化成咽发育所需的合子基因转录的信号。
卵裂与胚轴的建立小结
- A/P轴在第一次分裂时就已明确,精子的进入启动了A/P轴的明确。母体决定因子的非对称分布对正确的 A/P 轴规范至关重要。
- D/Vaxis规格化涉及Wnt和Notch信号介导的局部细胞-细胞接触。
- 肠道的发育源自单个 EMS 细胞的后代,在 2 细胞阶段由母体决定因素(SKN)以及在 4 细胞阶段由邻近的 P2 细胞发出的诱导信号(Wnt)决定。