5.果蝇的发育
导航
一、果蝇对现代生物学的贡献
果蝇作为模式生物,对现代生物学尤其是遗传学和发育生物学的发展起到了关键的推动作用。其研究历史可以追溯到20世纪初,当时托马斯·亨特·摩尔根及其学生在哥伦比亚大学的果蝇实验室中,通过果蝇的遗传学研究,揭示了许多遗传学的基本原理,如性连锁、基因的线性排列等,并引入了“基因”这一概念,为现代遗传学奠定了基础。此后,果蝇研究不断取得突破,六次获得诺贝尔奖,彰显了其在科学界的重要地位。
果蝇与遗传
果蝇与遗传学的渊源深厚,其研究为遗传学的发展做出了巨大贡献。
人们通过果蝇发现了性染色体的存在,提出了性连锁的概念:果蝇白眼基因的性连锁,雄蝇是异配的。在哥伦比亚大学的果蝇实验室中,摩尔根团队通过观察果蝇的自发突变,提出了基因位于染色体上的理论,并引入了“基因”这一术语,还提出了基因在线性排列的理论,单位相对距离被称为“centiMorgan”。此外,他们还发现X射线照射可以诱导果蝇及其他物种发生突变,这一发现极大地推动了遗传学研究的进程。
果蝇研究的贡献
果蝇研究的贡献不仅限于遗传学领域,还广泛涉及发育生物学、神经生物学、细胞生物学和免疫学等多个学科。
- 发育生物学方面,果蝇是研究胚胎发育、体节形成和器官形成的经典模型,许多关键的发育信号系统如Notch、Hedgehog、Wingless/Wnt等都是通过果蝇的遗传学研究首次发现的。
- 神经生物学领域,果蝇的嗅觉、节律等研究为理解神经系统的功能和机制提供了重要线索。
- 此外,果蝇研究还通过遗传学手段推动了细胞生物学和免疫学的发展,例如在天然免疫方面的研究。
这些跨学科的贡献使得果蝇成为现代生物学研究中不可或缺的模式生物,为科学家们提供了丰富的研究工具和理论基础,促进了整个生物学领域的进步。
为什么研究果蝇
研究果蝇具有多方面的优势和重要意义
- 果蝇具有短生命周期,从受精卵到成虫仅需约两周时间,这使得研究人员能够在较短时间内观察到完整的发育过程和遗传变异。
- 果蝇的胚胎发育过程在24小时内即可完成,且早期胚胎为多核合胞体,这些特点使果蝇胚胎发育过程易于观察和操作,便于研究人员进行详细的细胞和分子层面的研究。
- 果蝇的基因组相对简单,仅有4条染色体,且与人类基因组有超过60%的相似性,约77%导致人类疾病基因在果蝇中存在同源基因,这为研究人类疾病的发生机制和寻找治疗方法提供了便利。
- 果蝇的突变体资源丰富,拥有大量巧妙的遗传技巧和全基因组筛选方法,这些资源为深入研究基因功能和遗传网络提供了有力支持。
- 果蝇研究成本较低,饲养容易。
二、果蝇的胚胎发育
受精
果蝇的受精是一系列不同寻常的事件,与我们之前所描述的受精过程有很大的不同。
- 精子进入一个已经激活的卵。果蝇卵的激活在产卵时就已经完成,也就是在受精开始前几分钟。在果蝇的卵母细胞经过一个狭小的孔隙被挤出来的时候,钙通道开放并且钙离子流入。然后卵母细胞核重启减数分裂,细胞质中的一些 mRNA 在没有受精的情况下开始翻译。
- 只存在一个精子入卵的位置——精孔(micropyle),一个位于胚胎未来背前部区域卵壳上的通道。精孔一次仅允许一个精子通过,可能是为了防止发生多精入卵。尽管可以观察到皮质变化,但没有防止多精入卵的皮质颗粒。
- 精子与卵细胞膜不融合。相反,精子完整地进入卵。雌、雄原核的 DNA 在原核融合之前复制。在原核融合之后,直到第一次有丝分裂结束,母本和父本的染色体保持分离。 一个果蝇的卵只能在将来变成胚胎前部的卵母细胞区域受精。此外,精子的尾部似乎保留在这个位置。
表面卵裂:合胞体胚盘到细胞化胚盘
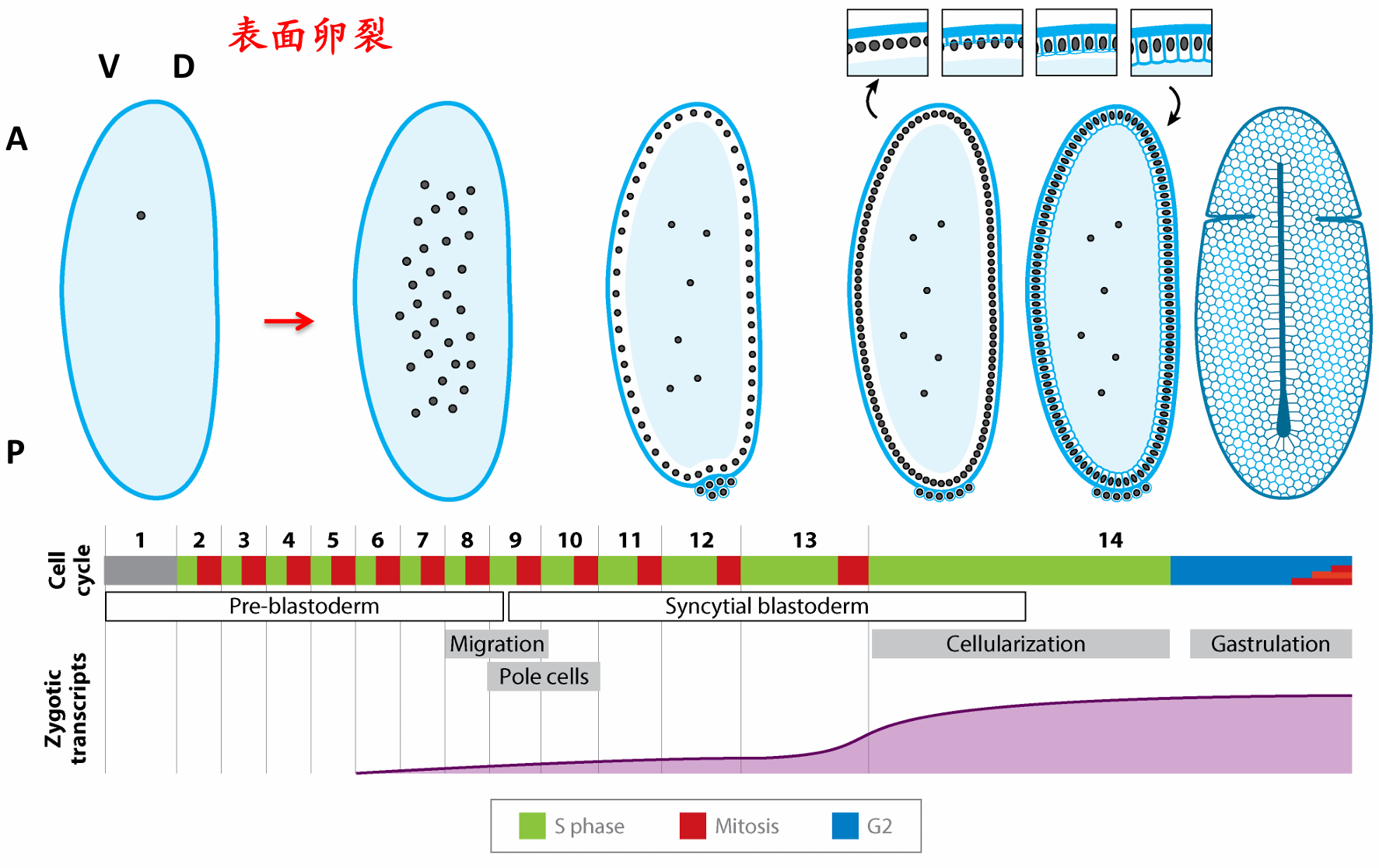
表面卵裂的示意图
大部分昆虫的卵进行表面卵裂(superficial cleavage),大量的中央卵黄将卵裂局限在卵的细胞质边缘 。这种卵裂方式是直到细胞核分裂几次之后细胞才得以形成。在果蝇的卵中, 核分裂并不伴随着细胞质分裂(细胞分裂),这样就形成一个合胞体(syncytium),即多核共享同一细胞质的单一细胞。
合子细胞核在卵的中心区域进行几次核分裂;连续的8次细胞核分裂(平均每8 min 一次)产生了256个细胞核。这一快速分裂过程由没有间期(G)的多轮细胞分裂周期交替来完成。在第9个分裂周期,大约5个细胞核到达胚胎后极的表面。这些核被细胞膜包裹,形成了产生成体配子的极细胞(pole cell)。在第10个分裂周期,其他细胞核迁移至卵皮质(周缘),继续进行有丝分裂,但分裂速度逐渐减慢(分裂后期的细胞核平行于皮质进行分裂,使细胞核维持在细胞周缘)。 在这些时期的细胞核分裂过程中,除了卵本身的细胞膜之外没有新的细胞膜形成,因此这时的胚胎被称为合胞体胚盘(syncytial blastoderm)。
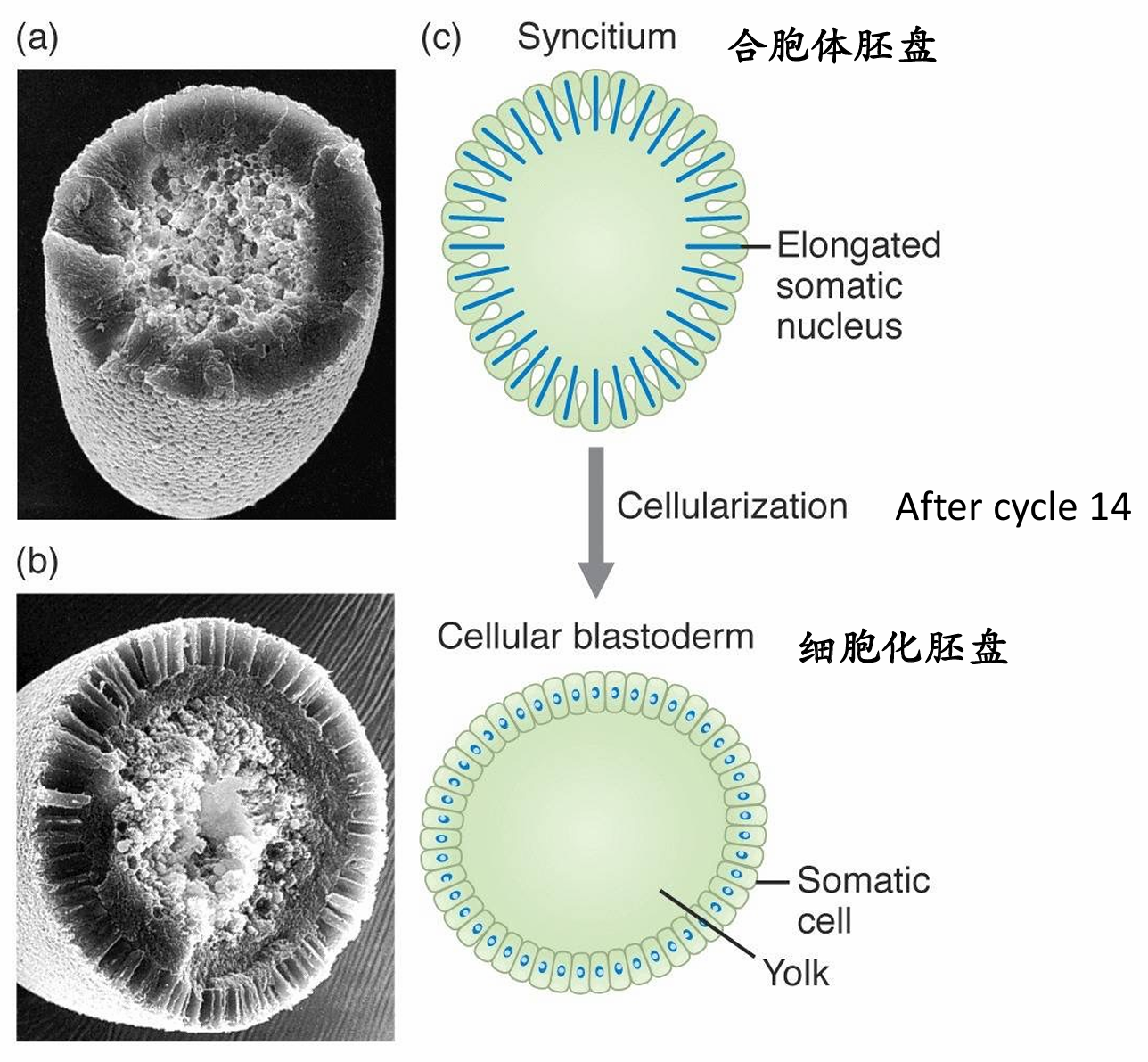
”合胞体胚盘——>细胞化胚盘“示意图
合胞体胚盘中细胞质很不均一,每个细胞核都被容纳在自身的细胞骨架蛋白所形成的微小区域内。在第10个分裂周期过程中, 细胞核迁移到卵的周缘,被微管和微丝所包围。细胞核以及与之相关的细胞质岛被称为活质体(energid)。在第13个分裂周期之后,细胞膜(覆盖整个卵)在细胞核之间向内发生褶皱,将每个活质体分割成单个细胞。这一过程形成了细胞胚盘(cellular blastoderm),其中所有的细胞排列组成 一个单细胞层,覆盖在卵的多卵黄核心周围。
细胞胚盘的形成涉及微管和微丝之间的一系列精细相互作用,膜的运动、核的延伸、肌动蛋白的聚合似乎都受微管的协调。胚盘细胞化的第一阶段是以细胞核之间的细胞膜内陷而形成沟道为特征。在沟道通过细胞核的水平之后,开始发生细胞化的第二阶段,内陷速度加快,肌动蛋白-膜复合物在将要成为细胞基端的位置开始收缩。果蝇的细胞胚盘由大约6000个细胞组成,在受精后4 h内形成。
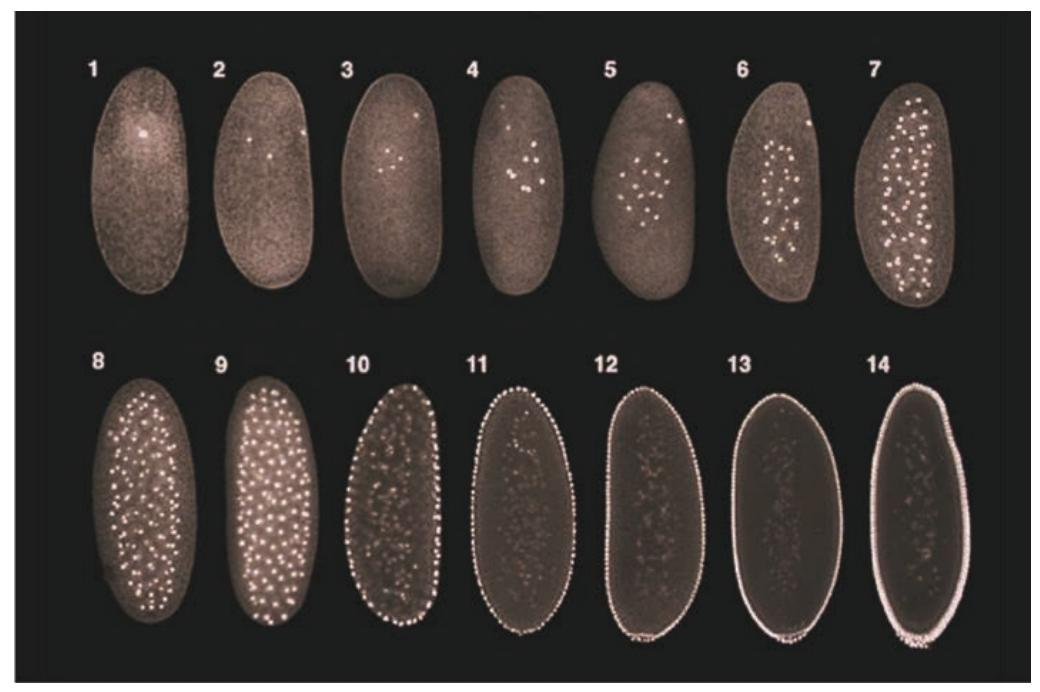
胚胎上方是将来的前端;数字代表核分裂周期。早期的核分裂发生在合胞体中央。后来,细胞核与其周围的细胞质岛(活质体)迁移到细胞周缘,形成合胞体胚盘。在第13个分裂周期后,细胞膜 在细胞核之间内移,从而形成细胞胚盘。极细胞(生殖细胞 前体)在后部形成.
囊期中期转换:母源-合子基因组转换
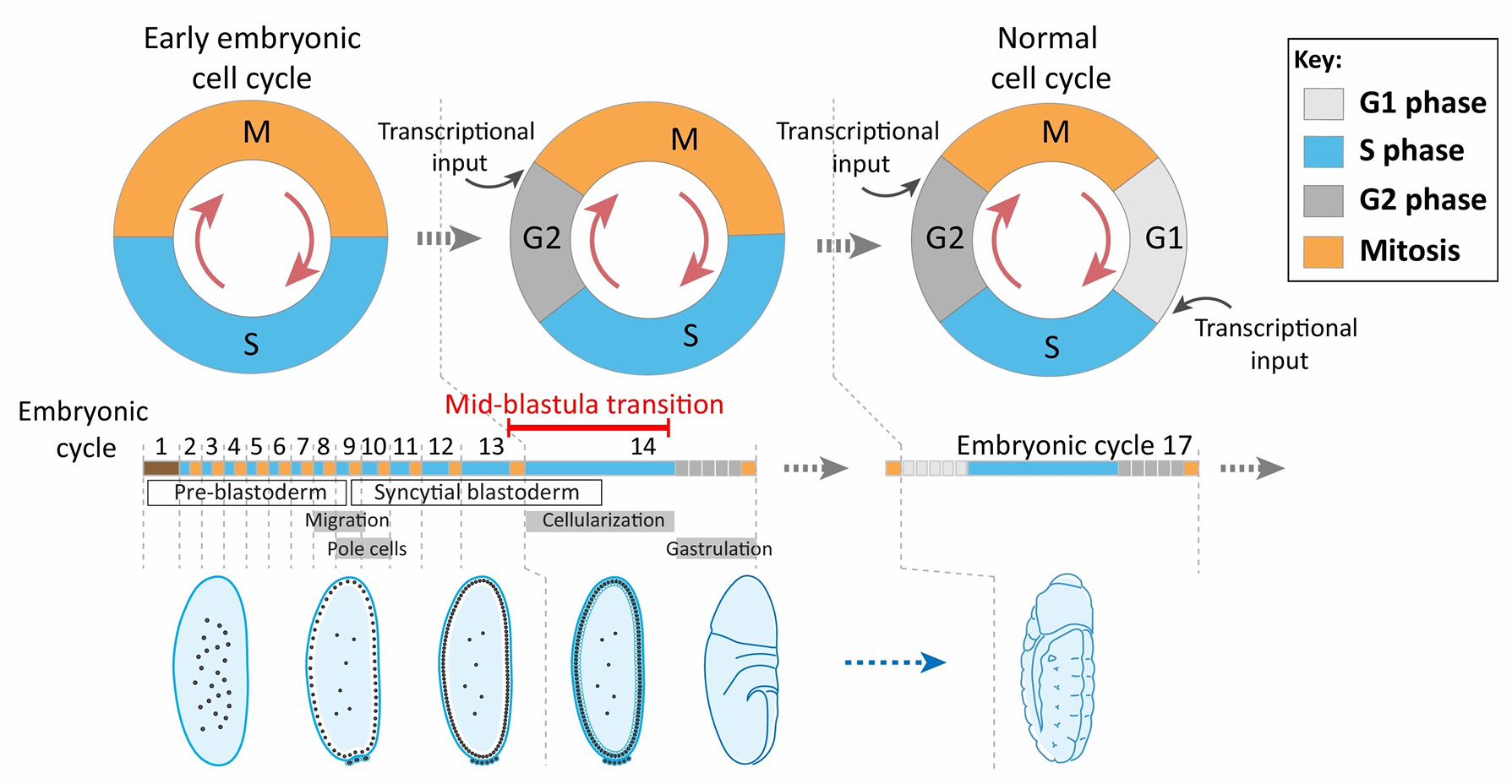
囊胚中期转换(Mid-blastula transition ,MBT)示意图
当细胞核到达外围之后,在随后的四次分裂中每次分裂完成的时间逐渐变长。从第1到第10个分裂 周期的平均周期时间是8 min。第13个周期,也就是合胞体胚盘的最后一个周期,需要25 min才能完成。 果蝇胚胎形成细胞的第14个周期(即第13个周期之后)的分裂变得不同步。一些细胞完成这一周期需要75 min,另一些则需要175 min。 在这一时间点,细胞核基因开始变得活跃。在这之前,卵子发生过程中储存在卵中的一些蛋白质和 mRNA引导早期发育。它们是母体基因的产物,而不是胚胎自身细胞核中的基因产物。在母体中具有活性的基因产生一些用于后代早期发育的产物,这些基因通常被称为母体效应基因(maternal effect gene)。
在卵母细胞中的mRNA通常被称为母体信使(maternal message)。合子基因的转录(也就是胚胎自身基因的激活)大概起始于第11个分裂周期,并在第14个周期时大幅度增强。这样一个细胞核分裂减缓、 细胞化和伴随着新RNA转录升高的过程通常被称为中囊胚期转换(mid-blastula transition)。在这一时期, 母体提供的mRNA被降解,对发育的调控被转交到合子自身的基因组。在众多的脊椎和无脊椎动物门中都可以见到这种母体到合子的转换。
注意:母体效应基因在异步分裂发生之前就已经开始被激活;
果蝇的中囊胚期转换机制 中囊胚期转换和母体到合子转换的协调受几个因素控制,包括:
- ①染色质与细胞质的比率;
- 母系单倍体(蛋白酶)或父系单倍体(端粒封顶蛋白)胚胎在细胞化之前多进行第 14 次 DNA 分裂(DNA 较少)。
- 提供更多精子或 DNA 会导致 MZT 过早出现(更多 DNA)。
- ②Smaug蛋白;
- 由母体 mRNA 编码,针对母体 mRNA 进行破坏的 RNA 结合蛋白,在第 11 周期达到峰值。
- ③转录因子Zelda
- 由母体 mRNA 编码,与许多最早转录的合子基因中的 CAGGTAG 矩阵结合:性别决定、卵母细胞的 A/P 和 D/V 极性。
原肠运动(胚胎延伸与回缩)
果蝇胚胎、幼体和成体呈现出相同的基本躯体图式:都具有明显的头部和尾部,以及位于中间的重 复性体节单元。在这些体节中,3个形成胸部,其他8个形成腹部。成体果蝇的每个体节都具有自身的特征。例如,第一胸节只有腿,第二胸节具有腿和翅,而第三胸节具有腿和平衡棒(平衡器官)。
在中囊胚期转换后不久便发生原肠胚形成。果蝇原肠胚形成过程中最先开始的细胞运动将预定中胚 层、内胚层和外胚层分隔开来。预定中胚层由位于胚胎腹部中线的大约1000个细胞组成,这些细胞向内发生褶皱而形成腹沟(ventral furrow)。腹沟最终从腹部表面脱离,在胚胎内变成腹管。预定内胚层在腹沟的前后两端处内陷形成两个凹窝。极细胞与内胚层一起内部化。此时,胚胎发生弯曲,形成头沟(cephalic furrow)。
胚胎表面的外胚层细胞及中胚层进行集中和延伸,向腹部中线迁移,形成胚带(germ band),这是 一些沿腹部中线分布的细胞,包括那些将要形成胚胎躯干部的所有细胞。可能是由于卵鞘的原因,胚带向后延伸,包裹在胚胎的上部(背部)表面。因此,当胚带形成结束时,注定形成大部分后部幼体结构的细胞紧邻未来头部区域之后。此时,体节开始出现,将外胚层和中胚层分成区段。 而后,胚带回缩,将预定后部体节置于胚胎的后端。在背部表面,两侧的表皮在一个称为背向闭合(dorsal closure) 的过程中汇合在一起。羊浆膜(围绕胚胎的胚外层)是最背部的结构,与表皮细胞 相互作用,促进它们的迁移。
当胚带处在延伸的位置时,出现几个关键的形态发生过程:器官形成、分节、成虫盘的分离。神经系统形成于两个腹部外胚层区域。成神经细胞(即神经祖细胞)从成神经外胚层分化产生, 并向内迁移至每个体节的内部(成神经细胞也来自头部外胚层的不分节区域)。因此,在像果蝇这样的昆虫中,神经系统位于腹部,而不是像在脊椎动物中那样源于背部神经管)。 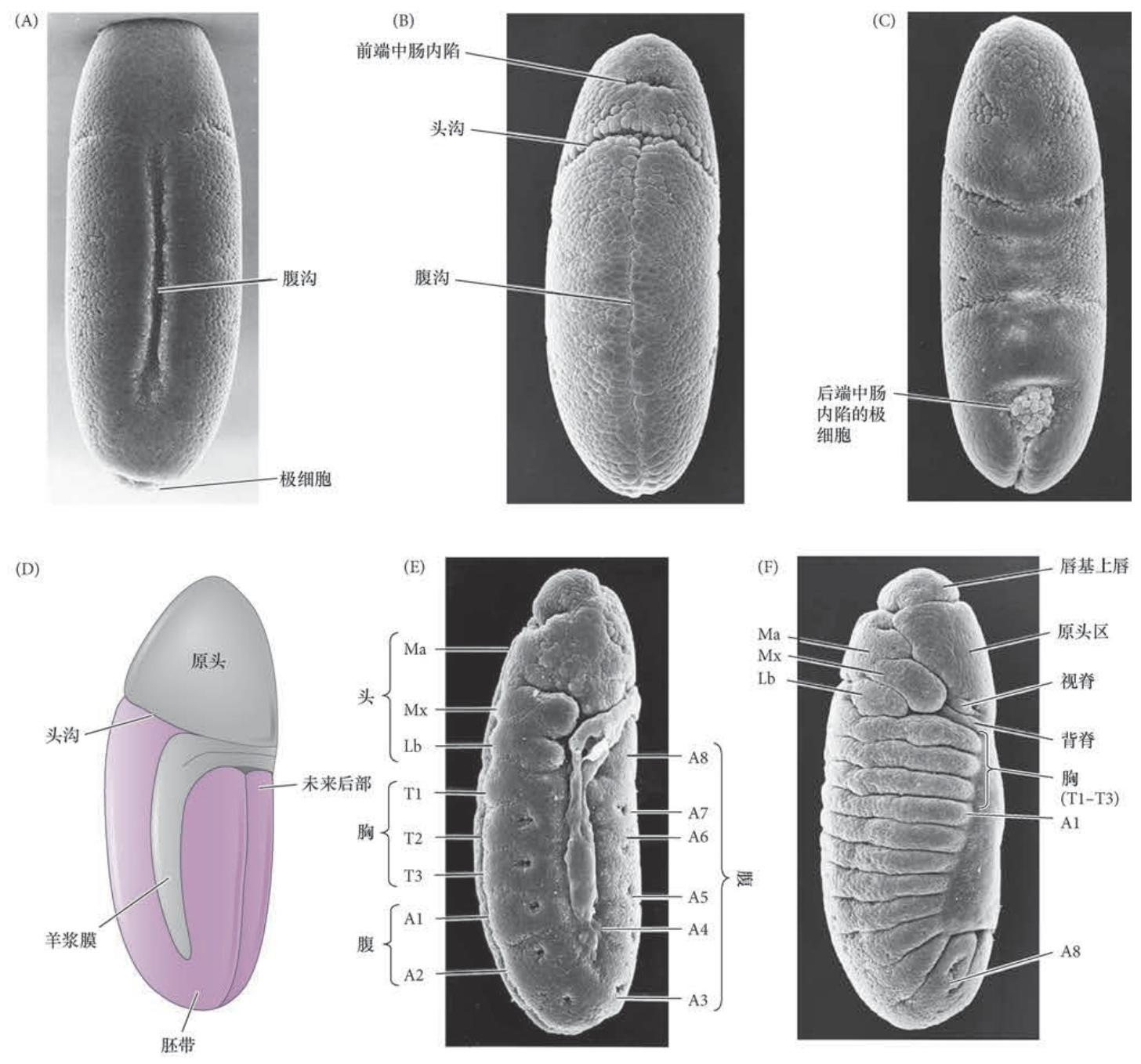
图9.5 果蝇的原肠胚形成。(A) 沿腹部中线两侧的细胞内陷,开始形成腹沟。(B) 腹沟闭合,中胚层细胞位于内部,表面外胚层位于腹部中线两侧。(C) 稍后时期的胚胎背部观,显示极细胞和后部内胚层陷入胚胎。(D) 一个胚胎在分节之前胚带 已经完全延伸的背侧面观示意图。头沟将未来头部( 原头) 与将要形成胸腹部的 胚带分开。(E) 侧面观,显示胚带的完全延伸和分节的起始。轻微的凹陷标志沿 胚带形成的新生体节。Ma、Mx 和Lb 对应于大颚、下颚和唇部的头节;T1 ~T3 是胸节;A1 ~A8 是腹节。(F) 胚带方向逆转。现在可见真正的体节,以及头部 背侧的其他一些区域,如唇基上唇、原头区、视脊和背脊。(G) 刚孵化的一龄幼体
体节形成、器官形成
三、果蝇幼虫变态发育
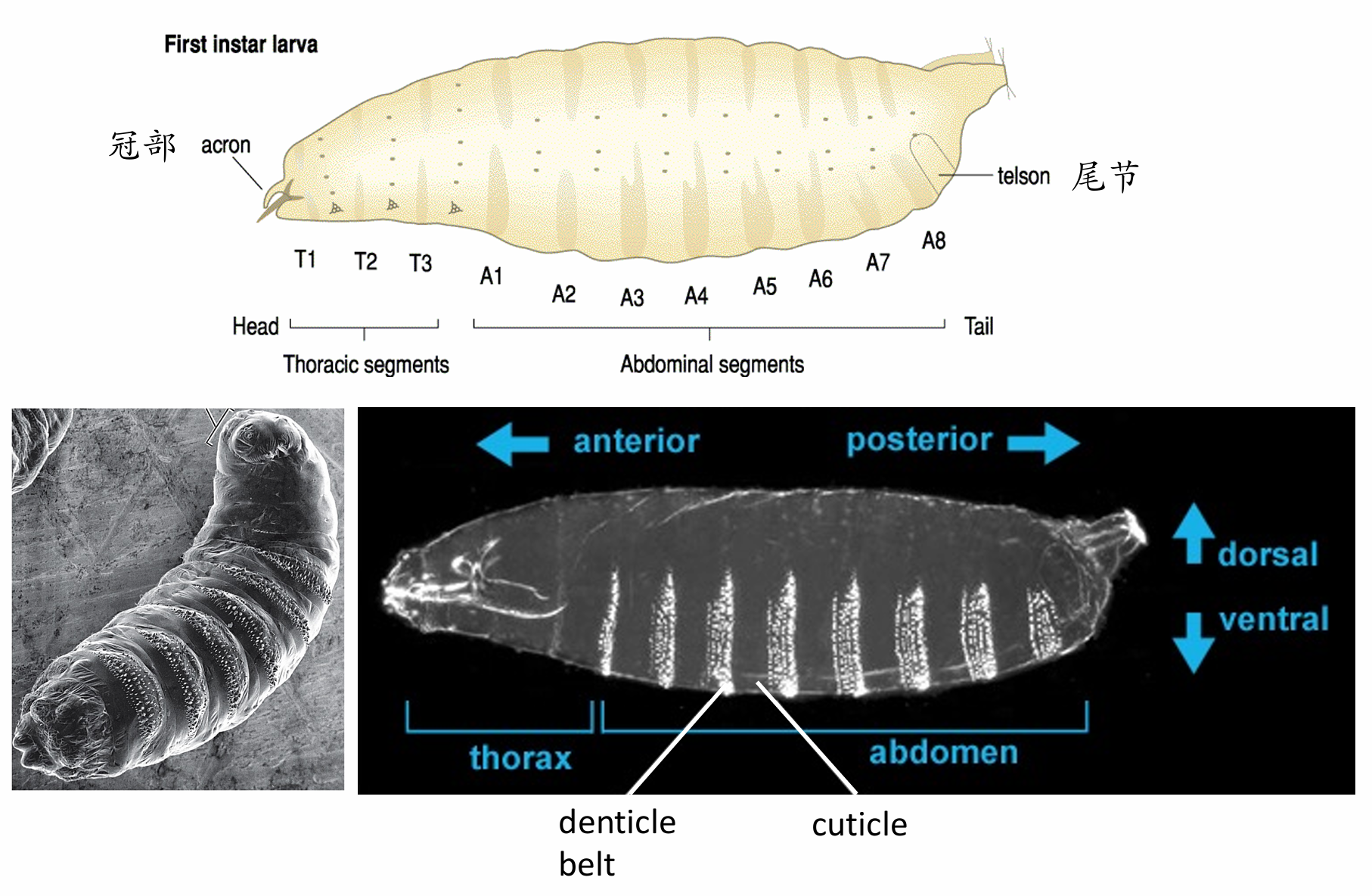
果蝇幼虫的变态发育
幼虫能在几天内通过进食从卵体大小(0.5毫米)长到正常形态大小(2.5毫米)。其间蜕皮两次,所以可以将它的幼体发育分成三个阶段(一龄二龄三龄)。晚期三龄幼虫从食物中爬出,寻找合适的位置并化蛹。幼虫身体缩短,角质层与表皮逐渐分离成为蛹壳,经过五天的变态发育,最后破蛹而出,成为成虫。蛹壳半透明,呈黄褐色,或深黄褐色,长椭圆形。蛹的前端有一呼吸管伸出。
四、卵母细胞极性的建立
卵母细胞极性和两轴的确立
- 在卵子生成过程(oogenesis)中部分形成
- 在合胞胚胎(syncyial blastoderm)中完成,从而将转录因子的浓度梯度解释成位置信息
- 两个轴各自以独特的机制同时建立
卵巢管(ovariole)的组成
果蝇的卵巢管(ovariole)是卵子发生的主要场所,其结构和功能对于卵母细胞的发育和极性建立具有重要意义。卵巢管由多个部分组成,包括生殖干细胞、成囊细胞、卵母细胞以及周围的卵泡细胞等。这些细胞类型在卵巢管中有序排列,共同协作完成卵母细胞的生长、分化和成熟。
生殖干细胞位于卵巢管的前端,它们具有自我更新和分化的潜能。这些干细胞不断分裂,产生新的细胞,这些细胞将进一步分化为卵母细胞或成囊细胞。成囊细胞则负责形成卵母细胞周围的囊状结构,为卵母细胞提供保护和营养支持。同时,成囊细胞还参与调节卵母细胞的极性建立和发育进程。
生殖干细胞和成囊细胞
生殖干细胞是卵巢管中最具活力和潜力的细胞类型之一。它们通过不对称分裂的方式,一方面保持自身干细胞的特性,另一方面产生具有分化潜能的子代细胞。这些子代细胞在信号分子和细胞间相互作用的引导下,逐渐向卵巢管的后端移动,开始分化为卵母细胞。
胚胎的发育过程也许正式起始于受精,但果蝇胚胎发育中许多至关重要的分子事件在卵子发生期间就已经启动。每个卵母细胞都是卵原细胞(oogonium)的后代细胞。在卵子发生开始时,卵原细胞进行四次不完全的胞质分裂,产生16个互相连接的细胞。这16个生殖系细胞与 环围它们的体细胞性卵泡细胞所形成的上皮层共同组成卵室(egg chamber)。 卵母细胞将在其中发育。这些生殖系细胞包括15个代谢活跃的抚育细胞(nurse cell),它们产生一些mRNA和蛋白质,并将其输送 到将要成为卵母细胞的那个细胞。当卵母细胞前体在卵室的后端发育时,抚育细胞产生大量的mRNA, 通过细胞间的相互连接沿着微管被输送到逐渐增大的卵母细胞。
成囊细胞则在卵母细胞的发育过程中扮演着重要的角色。它们不仅为卵母细胞提供物理支持和保护,还通过分泌各种生长因子和信号分子,调节卵母细胞的生长和极性建立。成囊细胞与卵母细胞之间的紧密联系和相互作用,确保了卵母细胞在发育过程中的正常形态和功能形成。
卵母细胞的前后极性建立
Gurken和Torpedo的相互作用使卵泡细胞 "后发"
- 由滋卵细胞(Nurse cells)产生的gurkenmRNA 被运送到卵母细胞的细胞质中,定位在卵母细胞的核和细胞膜之间, 在后端翻译成Gurken蛋白(EGF homolog)
- Gurken蛋白只在短距离扩散,与终端滤泡细胞(terminalfollicle cell)膜上的Torpedo(EGFR homolog,Gurken受体)结合,使这些滤泡细胞成为后轴滤泡细胞(posteriorfolliclecell)
卵母细胞微管的重新定向和母体RNA的定位
- 后轴滤泡细胞向卵母细胞发送⼀个未知的信号,激活protein kinase A(脂激酶)
- PKA 磷酸化Par1,重组卵母细胞的微管,使其⽣长端(+end)朝向后部
- 不同的微管马达蛋白沿不同方向运输mRNA或蛋白载荷,因此微管的方向是关键的。驱动蛋白将物质输送到微管正端,动力蛋白是将物质输送到微管负端
- 驱动蛋白沿微管向卵母细胞后端输送oskar信使RNA,在到达后部皮质时被翻译成蛋白质。Oskar蛋白招募更多的Par-1蛋白,以此稳定微管的定向,并使更多物质被招募到卵母细胞的后极
卵母细胞中的细胞骨架重排伴随着细胞体积的增加,这是由于抚育细胞的细胞质组分输入的结果。 这些组分包括一些母体信使RNA,如bicoid和nanos。
母源bicoid和nanosRNA 通过马达蛋白运输到卵母细胞的特定部位,启动前-后轴的形成。
- bicoid 信使位于靠近受精卵的前部末端,而nanos信使则位于后部末端。这种分布是卵母细胞发育过程中 微管网络迅速极化的结果。
- 这两种 mRNA 一直处在休眠状态,只有在产卵和受精时它们才会被翻译
- bicoid和nanos被翻译成蛋白质后,在合胞体胚盘中扩散,形成了产生前-后轴所必需的梯度
- 当细胞核分裂时, 每个细胞核都会通过这两个蛋白质的比例而被赋予位置信息。 形成这些梯度的蛋白质激活一些赋予幼体和成体果蝇分节特征 的基因
特异性翻译抑制物梯度
- 母体mRNA,hunchback(hb)和caudal(cad),分别对前部和后部区域的图式化形成至关重要
- 这两个mRNA均匀分布于整个合胞体胚盘,但hb和cad的翻译分别被Nanos和Bicoid 蛋白的扩散梯度所抑制
卵母细胞背腹轴极性的建立
Gurken/Torpedo 相互作用使卵泡细胞 "背化"
- 卵母细胞核连同gurkenmRNA 由微管运送到背前部
- GurkenmRNA 和蛋白形成⼀个沿着卵母细胞的背面由前到后的浓 度梯度。Gurken蛋白与背前部的滤泡细胞膜上Torpedo结合,使这 些滤泡细胞成为背轴滤泡细胞(dorsalfolliclecells)
边缘细胞和极体
边缘细胞迁移
- 来自 650 个卵泡细胞的 4-8 个边界细胞和 2 个极性细胞
- 最终形成卵孔
- 用于精子进入和 A/P 模式信号的表达
五、胚胎背腹轴的确立(天然免疫)
Dorsal浓度梯度与背腹轴建立
dorsal基因的母体mRNA转录产物被抚育细胞输送到卵母细胞,直到受精后大约90 min才被翻译出来,并且广泛分布在合胞体胚盘,而不是定位在背侧或腹侧。 但它只在胚胎的腹部被转运到细胞核,作为一个转录因子与 一些基因结合后激活或者抑制它们的转录。如果Dorsal不能进入细胞核,那么参与特化腹部细胞类型的 基因就不能转录,而参与特化背部细胞类型的基因就不能受到抑制,因此胚胎的所有细胞都将被特化成 背部类型的细胞。
对一些母体效应突变的分析支持果蝇中这个背-腹轴形成的模型。这些突变产生了完全背部化或者完 全腹部化的表型。如果幼体胚胎中不存在“背部”,它们就会很快地死亡(Anderson and Nüsslein-Volhard 1984)。在所有的细胞都呈现背部化的突变体中(以它们的背部特异性外骨骼为标志),Dorsal没有进入 任何细胞的细胞核。相反,在所有细胞都呈现腹部化表型的突变体中,每个细胞的细胞核中都有Dorsal 蛋白(图9.29A)。
Dorsal浓度梯度的建立
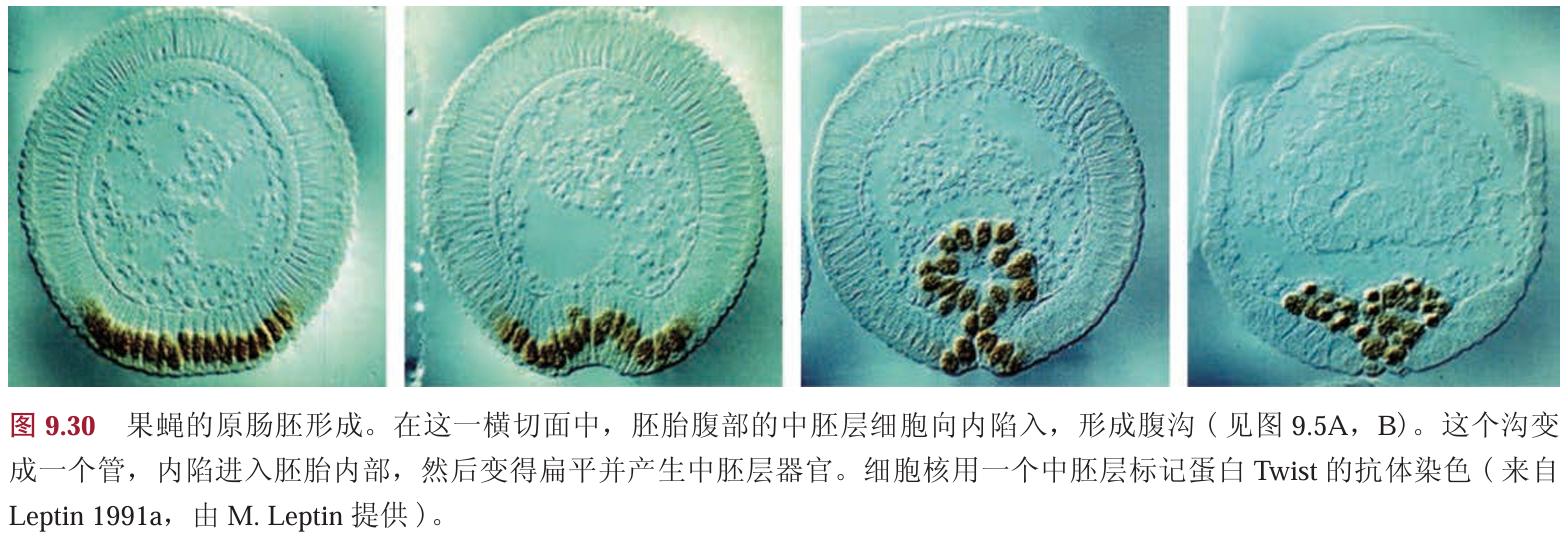
在合胞体胚盘的细胞质中,Dorsal蛋白一翻译出来便与Cactus 蛋白形成复合物,从而被滞留在细胞质中。当Spätzle蛋白在腹部结合并激活Toll受体时,Toll激活一个称为Pelle的蛋白激酶,另一个蛋白质Tube,可能将Pelle带到细胞膜,并且在这个位置Pelle被活化。活化的Pelle 蛋白激酶(可能通过一个中间物)能使Cactus磷酸化。一旦被磷酸化,Cactus随即就被降解, Dorsal 蛋白就可以进入细胞核。因为 Toll 被 Spätzle 蛋白梯度激活,进而形成Dorsal蛋白的转运梯度,这个梯度的最大浓度位于最腹部细胞的细胞核中,而这些 细胞将成为中胚层(图9.29B)。
Dorsal 蛋白为果蝇原肠胚形成的第一个形态发生事件传递信号。最腹部的16个细胞,也就是细胞核 中具有最多Dorsal蛋白的那些细胞,内陷形成中胚层(图9.30)。所有的肌细胞、脂肪体和生殖腺都来自 这些中胚层细胞(Foe 1989)。位于腹部中线的细胞将成为神经和胶质细胞。
背腹轴是由Toll调控的Dorsal浓度梯度决定的
- 受精后 90 分钟,Dorsal mRNA被翻译;均匀表达并与Cactus结合:无核定位
- Toll 蛋白(跨膜受体)被其配体 Spätzle 激活,形成 Toll活性梯度,从腹侧到背侧
- Dorsal蛋白通过 Toll 激活信号进入细胞核
- 核Dorsal蛋白梯度的形成建立 D-V 轴
Toll pathway and innate immunity
- Toll/Dorsal 调节也在果蝇的先天免疫中发挥作用
- 脊椎动物同源物: 作为 LPS(内毒素)受体的 TLR4(Toll 样受体 4)
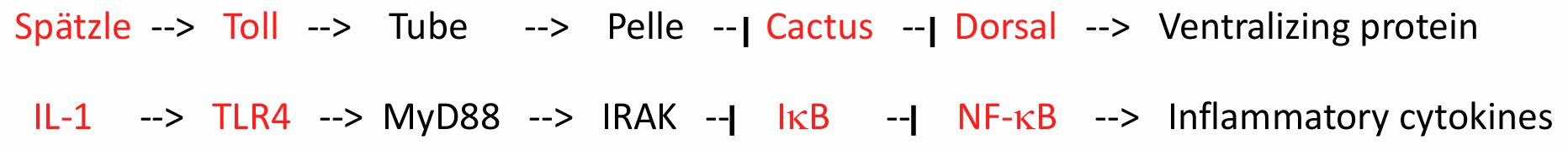
Dorsal 浓度梯度决定合子基因在背腹轴表达
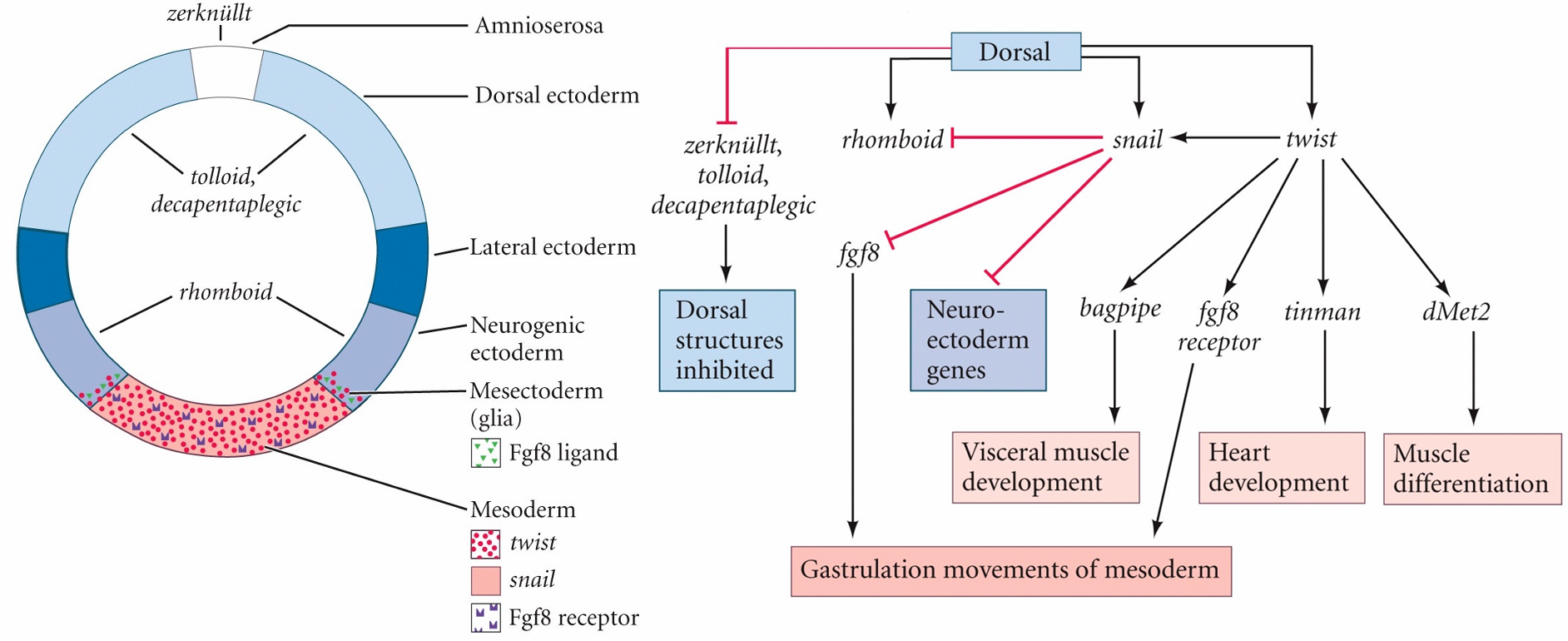
Dorsal与合子基因的相互作用关系图
腹侧区域Dorsal浓度最高,合子基因twist和snail沿腹侧被激活,这两个基因的表达是中胚层发育和原肠胚形成所必需的,最腹侧的细胞条带(1250 个细胞)将形成中胚层。rho基因的表达受到snail蛋白的抑制,而snail蛋白则被高水平的Dorsal蛋白激活,所以rho在腹侧区域不表达,而是在Dorsal蛋白低水平区域表达,那里将在未来形成神经直胚层(Neurogenic ectoderm)。
基因 decapentaplegic (dpp)、tolloid 和 zerknüllt (zen) 受到背侧蛋白的抑制,在背侧几乎没有Dorsal蛋白的区域表达。zen基因在最背侧区域表达,涉及羊浆膜的形成。
背侧区域是由Dpp活性梯度决定
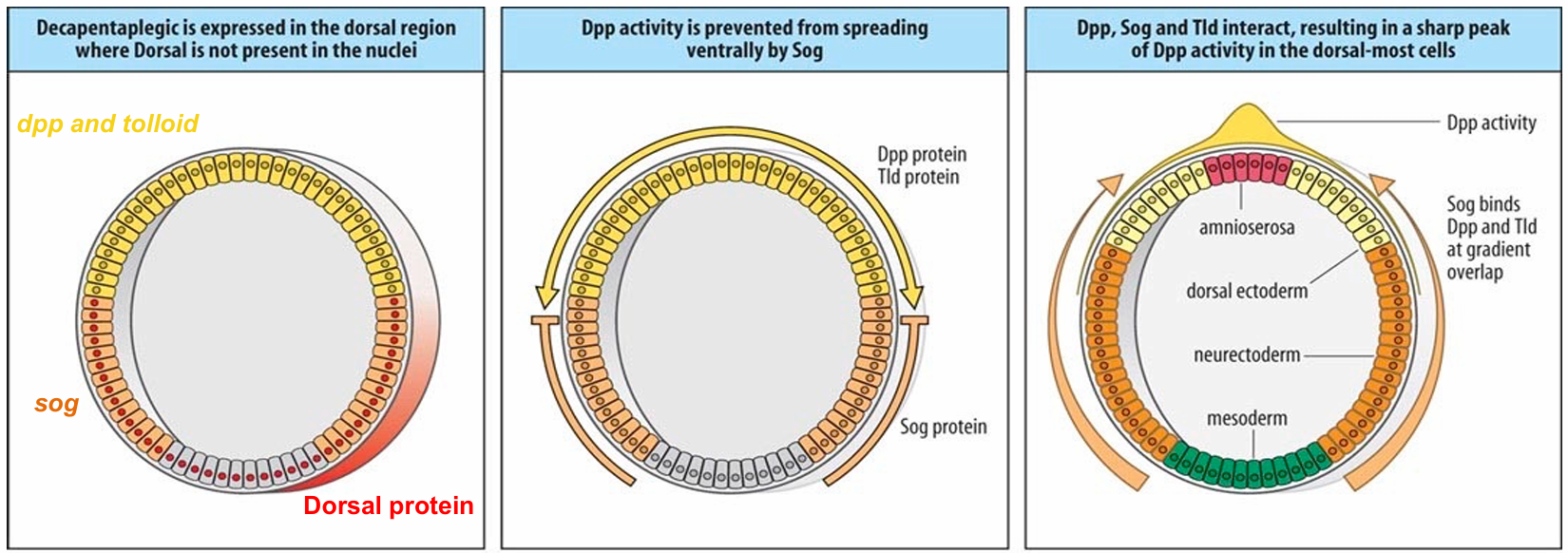 将 dpp RNA 注入早期胚胎,Dpp 浓度升高会使胚胎更倾向于背侧命运。腹侧外胚层变为背侧外胚层
将 dpp RNA 注入早期胚胎,Dpp 浓度升高会使胚胎更倾向于背侧命运。腹侧外胚层变为背侧外胚层
Dpp 蛋白最初在细胞化阶段的背侧区域均匀表达
- 1 小时内,其活性仅限于由 5-7 个细胞组成的背侧条带,在邻近的背侧外胚层的活性则低得多
- Sogshuttles Dpp回到最背侧细胞
- Dpp活性梯度:最高Dpp Þamnioserosa(最背侧细胞的命运) BMP4 家族的另一个成员 Sog(Chordin) 在腹侧区域被核 Dorsal 梯度激活,形成从腹侧到背侧的梯度
六、胚胎前后轴的建立(信号转导)
胚胎前后的建立涉及诸多具有上下游调控关系的基因,这些基因参与:(1)建立前-后极性;(2)将胚胎分成特定数目的体节,每个体节都具有不同的特征。 这个调控关系首先由母体效应基因(maternal effect gene) 启动,它们产生的信使RNA定位于卵的不同区 域。这些mRNA编码一些调节转录或翻译的蛋白质,然后这些蛋白质在合胞体胚盘中扩散,激活或者抑制一些合子基因的表达
- 大约 50 个母体效应基因(如 bicoid 和 nanos)mRNA 被置于未受精卵的不同区域,x建立极性
- 受这些母源因子调控的子代间隙基因在某些宽泛的部分重叠区域表达,将胚胎划分为宽泛的区域
- 不同浓度的间隙基因蛋白产物会激活/抑制配对规则基因的转录,而配对规则基因则确定胚胎的分割计划
- 配对规则基因蛋白激活区段极性基因的转录,从而确定区段的边界和极性。
- 间隙、配对规则和节段极性基因产物相互作用,调控同源选择基因,从而决定每个节段发育命运
前后图式建立的大致过程
最先表达的合子基因是一些裂隙基因(gap gene),这些基因的突变会导致分节图式出现裂隙。它们表达在一些较宽(大约三个体节宽度)和部分重叠的区域。裂隙基因编码转录因子,不同组合和浓度的裂隙 蛋白调节成对规则基因(pair-rule gene) 的转录,而这些基因再将胚胎分成周期性的单元。不同的成对规则 基因的转录产生了一个由7条横向带形成的条带图式,与前-后轴垂直。成对规则基因编码的转录因子激活体节极性基因(segment polarity gene)。这些基因的mRNA和蛋白质产物将胚胎分成14个体节单元,从而形成胚胎的周期性。同时,裂隙基因、成对规则基因及体节极性基因的蛋白质产物相互作用,调节另一组基因,即同源异形选择者基因(homeotic selector gene) 的表达。这些基因的转录决定了每个体节的发育命运
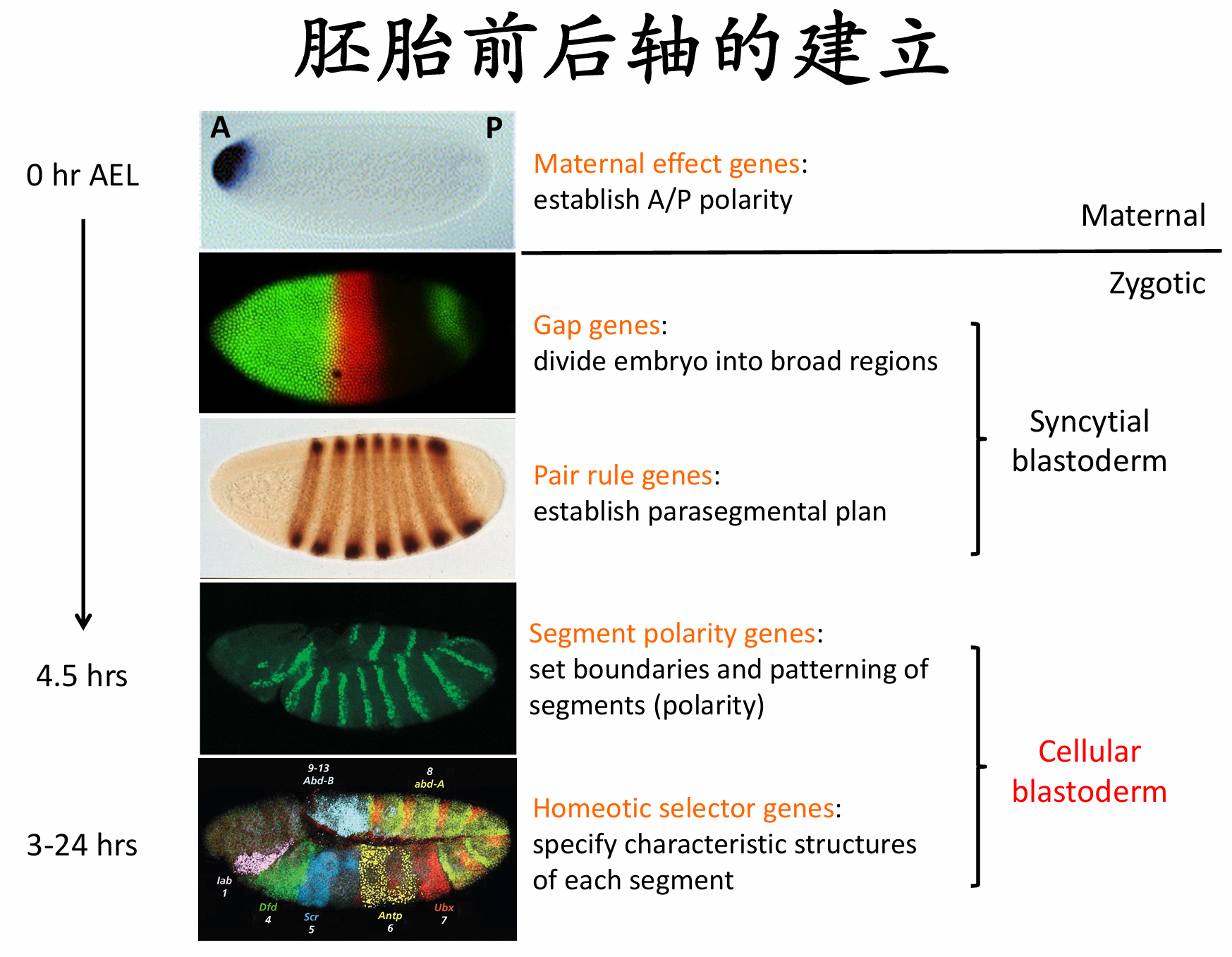
前后轴建立过程中不同基因的作用顺序
母体效应基因的作用
建立果蝇胚胎前后极性涉及到的母体效应基因有很多,不同母体RNA翻译水平上基因调节的平行作建立果蝇胚胎的前-后图式

卵巢的抚育细胞将 bicoid、nanos、hunchback 和 caudal 的 mRNA输送到卵母细胞。bicoid信使被分隔在前部,nanos定位于后端。这些蛋白质被翻译后,Bicoid蛋白梯度从前部向后部延伸,而Nanos蛋白梯度从后部 向前部延伸。
Nanos抑制hunchback信使 的翻译(在后部),而Bicoid抑制caudal 信使的翻译(在前部)。这种抑制形成了 Caudal 和 Hunchback 的反向梯度。由于 hunchback 基因在前部细胞核中转录(因为Bicoid 是一个能激活hunchback基因转录的转录因子),Hunchback梯度又得以增强(绿色曲线的小突起)。 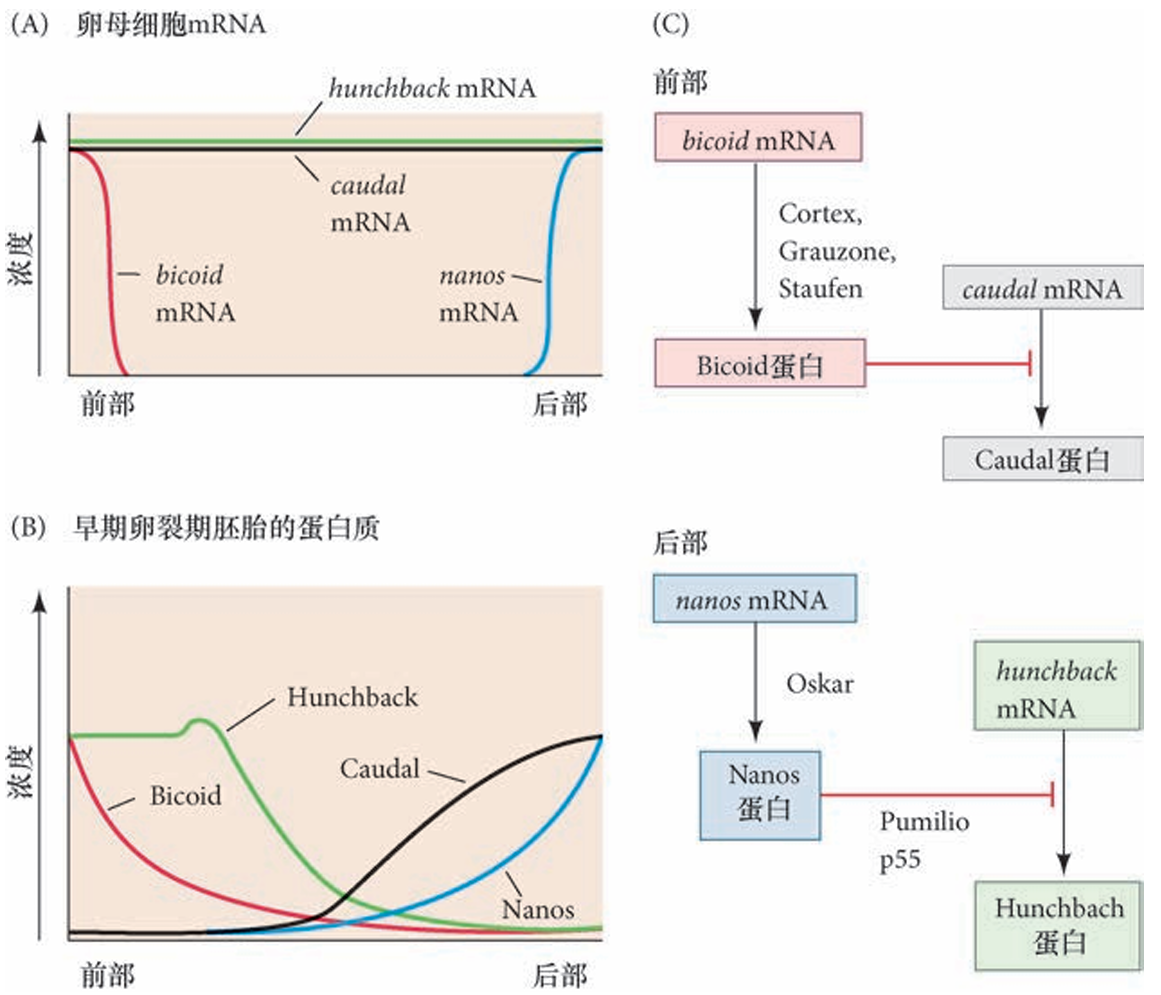
Bicoid 的主要功能是作为一个转录因子在胚胎的前部激活一些靶基因的表达,这些头部特异基因的启动子可能具有亲和力较低的Bicoid结合位点,导致它们只能被极高浓度的Bicoid蛋白所激活,也就是在靠近胚胎前端的位置。这些基因的激活除了需要高水平的Bicoid以外,它们的转录还需要Hunchback蛋白。Bicoid 和 Hunchback 在这些“头部基因” 的增强子上协同作用,以正反馈的方式促进它们的转录。后部形态发生素Nanos蛋白在翻译水平上抑制 前部的形成,通过Caudal蛋白在转录水平上激活形成腹部的基因。
除了前部和后部形态发生素以外,还有第三组母体基因,其蛋白质参与形成前-后轴的两个不分节 末端:头部末端部分(包括脑)的顶节(acron)和尾端的尾节(telson)。这些末端基因的突变会造成顶节、 最前部头节、尾节和最后部腹节的缺失。
分节基因
果蝇中细胞命运的定型似乎有两个步骤:特化和决定。在果蝇的早期发育过程中,细胞的命运依赖于蛋白梯度所提供的信息。这种细胞命运的特化是可变的,仍能够对来自其他细胞的信号做出应答而发生变化。然而,细胞最终会从这种可塑性的定型转变到不可逆转的命运决定。这时,一个细 胞的命运就变成了细胞的内在特性。
在果蝇中从特化到决定的转变受分节基因(segmentation gene)调控。分节基因将早期胚胎沿前-后 轴分成一系列重复的分节原基。分节基因最初是通过干扰躯体图式的合子突变而被鉴别出来的。根据它们所产生的突变表型可将这些基因分为三组:
- ● 裂隙基因突变体中缺失躯体的大部分区域(几个连续的体节;图9.15A);
- ● 成对规则基因突变体中每隔一个体节缺失一部分(图9.15B);
- ● 体节极性基因突变体中的每个体节都表现出缺陷,如缺失、重复、极性反转(图9.15C)。

常见的重要分节基因
体节与副体节
胚胎分割的第一个可见迹象是胚胎表面在胃形成后出现的沟纹
- 这些均匀分布的凹槽(瞬时结构)定义了副体节(parasegments)
- 副体节与最终节段(体节)相差约半个副体节,因此每个节段由一个副体节的后部区域和下一个副体节的前部区域组成
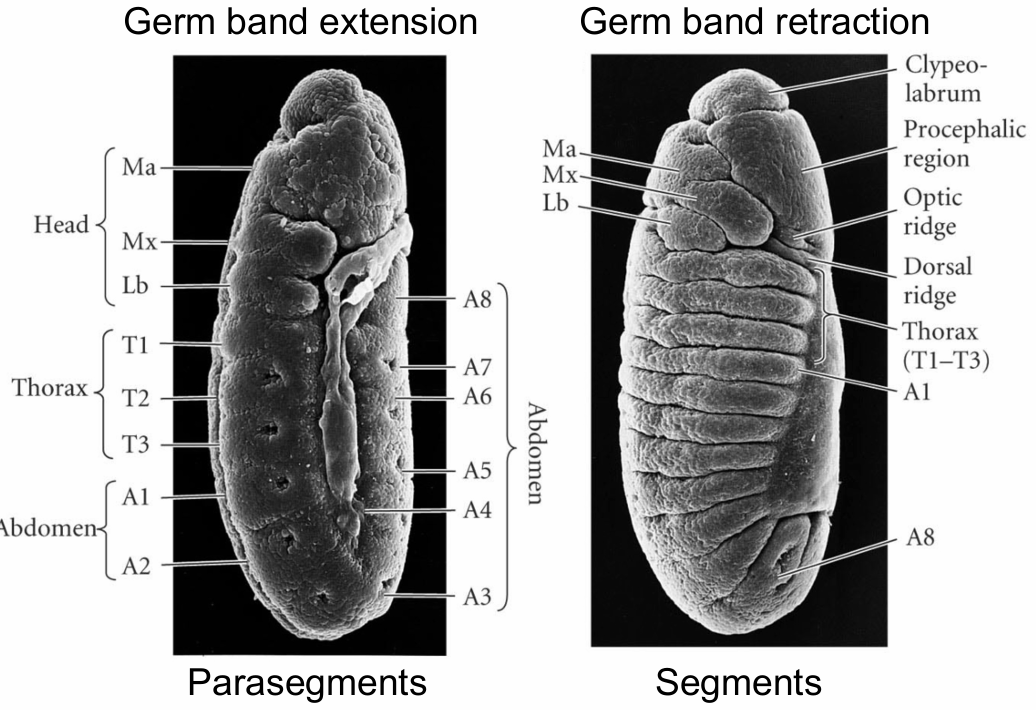
瞬时的凹槽与副体节
果蝇胚胎的副体节相对于体节向前移动了一个区室
人们发现早期胚胎的基因表达图式是由副体节边界而非体节边界所界定。因此,副体节好像是胚胎基因表达的基本单元。尽管在成体果蝇的神经索中也可见到副体 节的组织化,但在成体表皮(分节最明显的组织)和肌肉组织中却不存在。这些成体结构沿体节的图式被组织起来。在果蝇中,当胚带回缩时,表皮的分节沟开始出现;形成肌肉的中胚层在发育的晚期开始 分节。
我们可以认为体节和副体节的组织化体系是以不同的方式沿胚胎前-后轴组织一些区室。一个区室的细胞与相邻区室的细胞互不混合,并且副体节和体节被一个区室隔开
裂隙基因(gap gene)
裂隙基因受母体效应基因激活或抑制,并且沿前-后轴在一个或两个很宽的区域内表达。裂隙基因hunchback、Krüppel 和knirps 的突变所造成的缺失跨越果蝇胚胎的整个分节区域。裂隙基因giant与这三个基因相互重叠,而裂隙基因tailless和huckebein在靠近胚胎前后两端的区域内表达。总之, 躯干部分的四个裂隙基因具有足够的特异性,能限定一个细胞的位置,使其沿胚胎前-后轴方向所处的位置仅出现大约1%的误差。利用这些裂隙基因产物之间的相互作用,每个细胞都被赋予一个独特的空间特异性。
这些裂隙基因具有高度动态的表达图式。它们通常在整个胚胎内呈现低水平的转录活性。当核分裂 继续进行时,它们的表达呈现出不连续的高活性区域。Hunchback的梯度对建立裂隙基因的初始表达图式尤其重要。在核分裂的第12个周期结束时,Hunchback在胚胎的前部呈现高水平的表达。 然后,Hunchback在接近胚胎中部的大约15个细胞核处形成一个陡峭的梯度。这时,在胚胎的后1/3处检测不到Hunchback的表达。
前部裂隙基因的转录图式被Hunchback和Bicoid蛋白的不同浓度所启动。高水平的Bicoid和 Hunchback 诱导giant 的表达,而Krüppel 的转录物出现在Hunchback 开始下降的区域。高水平的 Hunchback( 在没有Bicoid 的情况下)也抑制后部裂隙基因(如knirps和giant)在胚胎前部的转录。最高浓度处于后端的Caudal蛋白梯度可能在胚胎后部激活腹部裂隙基因knirps和giant。因此, giant 基因具有两种激活方式:一种是 Bicoid 和 Hunchback 激活其前部的表达,另一种是Caudal激活其后部的表达。
在母体效应梯度和Hunchback建立了初步的裂隙基因表达图式之后,不同裂隙基因产物之间的抑 制性相互作用稳定并维持它们的表达。这些相互作用因为发生在尚无细胞膜形成的合胞体中而被进一步 促进。边界形成的抑制可能直接受控于裂隙基因的产物,因为所有四个主要的裂隙基因(hunchback、 giant、Krüppel 和 knirps) 都编码DNA 结合蛋白。图 9.17A 显示遗传学实验、生化分析和数学模拟所建立的一个模型。
这一模型描述了具有三个切换开关的网络(图9.17B~D)。其中的两个是Hunchback和Knirps之间, 以及Giant和Krüppel 之间的强烈相互抑制。第三个是Hunchback和Krüppel之间的浓 度依赖性相互作用。在高浓度的情况下,Hunchback抑制Krüppel蛋白的产生,但在中等水平下(处在大 约50%胚胎长度的位置),Hunchback则促进Krüppel蛋白的形成(见图9.17C)。
这些抑制性相互作用的最终结果是形成了一个mRNA表达图式相互重叠的精确体系。每个区域都是 一个使裂隙蛋白扩散到邻近胚胎区域的来源。因此,在相邻的裂隙蛋白表达区域之间形成了一个显著重叠 的区域(至少有8个细胞核,大致相当于两个体节原基)。Stanojeíc及其同事(1989)利用一种引人注目 的方式显示了这一效应。他们将细胞化的胚盘固定(见图9.2),然后用携带红色染料的抗体将Hunchback 蛋白染色,同时用携带绿色染料的抗体将Krüppel蛋白染色。具有这两个蛋白质的细胞化区域同时与两种 抗体结合,呈现出明亮的黄颜色(见图9.7C)。在胚胎的后部区域,Krüppel以相似的方式与Knirps发生 重叠(Pankratz et al. 1990)。这些表达图式的精确性因为有一些冗余增强子的存在而得以维持。如果一个 增强子失去作用,其他增强子将很可能仍会发挥功能(Perry et al. 2011)。
成对规则基因(pair rule gene)
裂隙基因的蛋白激活或者抑制成对规则基因。成对规则基因具有模块化的增强子,使得它们在 7 个“条纹”中被激活。这些基因的转录边界受裂隙基因限定。成对规则基因沿前-后轴形成7 个转录条带,每个条带都由2个副体节组成。
这些基因的转录图式将胚胎分成不同的区 段,是躯体分节图式的前体。如图9.18(及图9.7D) 所示,一个由细胞核组成的垂直条带(细胞刚开始形成)表达一个成对规则基因,而下一个细胞核条带不表达这个基因,但接着下一个条带又表达此基因。这样一个沿前-后轴形成的“斑马条纹”状图 式将胚胎分成15个亚单元。(Segments:C1-3, T1-3, A1-8)

目前已知有8个基因能通过这种方式将胚胎分区,它们彼此重叠,从而赋予副体节中的每个细胞一组特 定的转录因子(见表9.2)。初级成对规则基因包括hairy、even-skipped和runt,每个基因都在7个条带中表达。这三个基因都从零开始建立它们的条纹表达图式,并且在每个条纹中使用不同的增强子和调节机制。这些增强子经常是模块化的,在每个条带中表达的调控位于DNA的离散区域。这些DNA区域通常含有裂隙蛋白所识别的结合位点。因此,通常认为裂隙蛋白的不同浓度决定成对规则基因是否被转录。
- 每个条带都是独立的,对不同浓度和组合的间隙基因编码转录因子做出反应
- 成对规则基因的增强子区域由模块化单元组成, 使得每个增强子各自调节一个或者一对条带
- 复杂的顺式调节区域具有多个结合位点,被反式调节性裂隙基因和母体基因的蛋白质结合
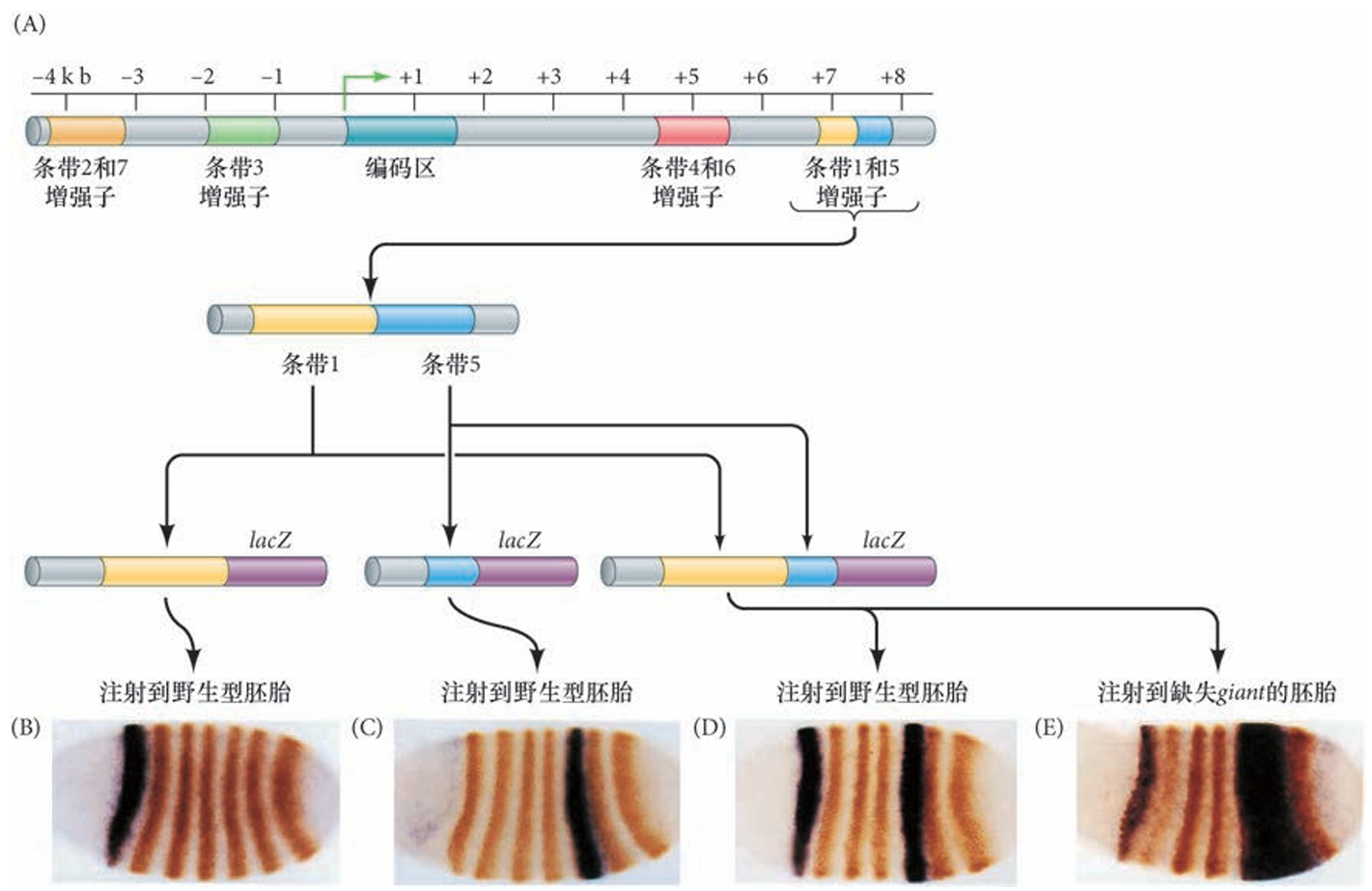
even-skipped基因的增强子区域
研究得最透彻的初级成对规则基因之一是even-skipped,其增强子区域由模块化单元组成, 使得每个增强子各自调节一个或者一对条带。例如,even-skipped的条带2受控于一个500碱基对的区域, 这个区域被Bicoid和Hunchback蛋白激活,也被Giant和Krüppel蛋白抑制。前部边界受到 Giant 的抑制作用而得以维持,而后部边界被Krüppel 维持。 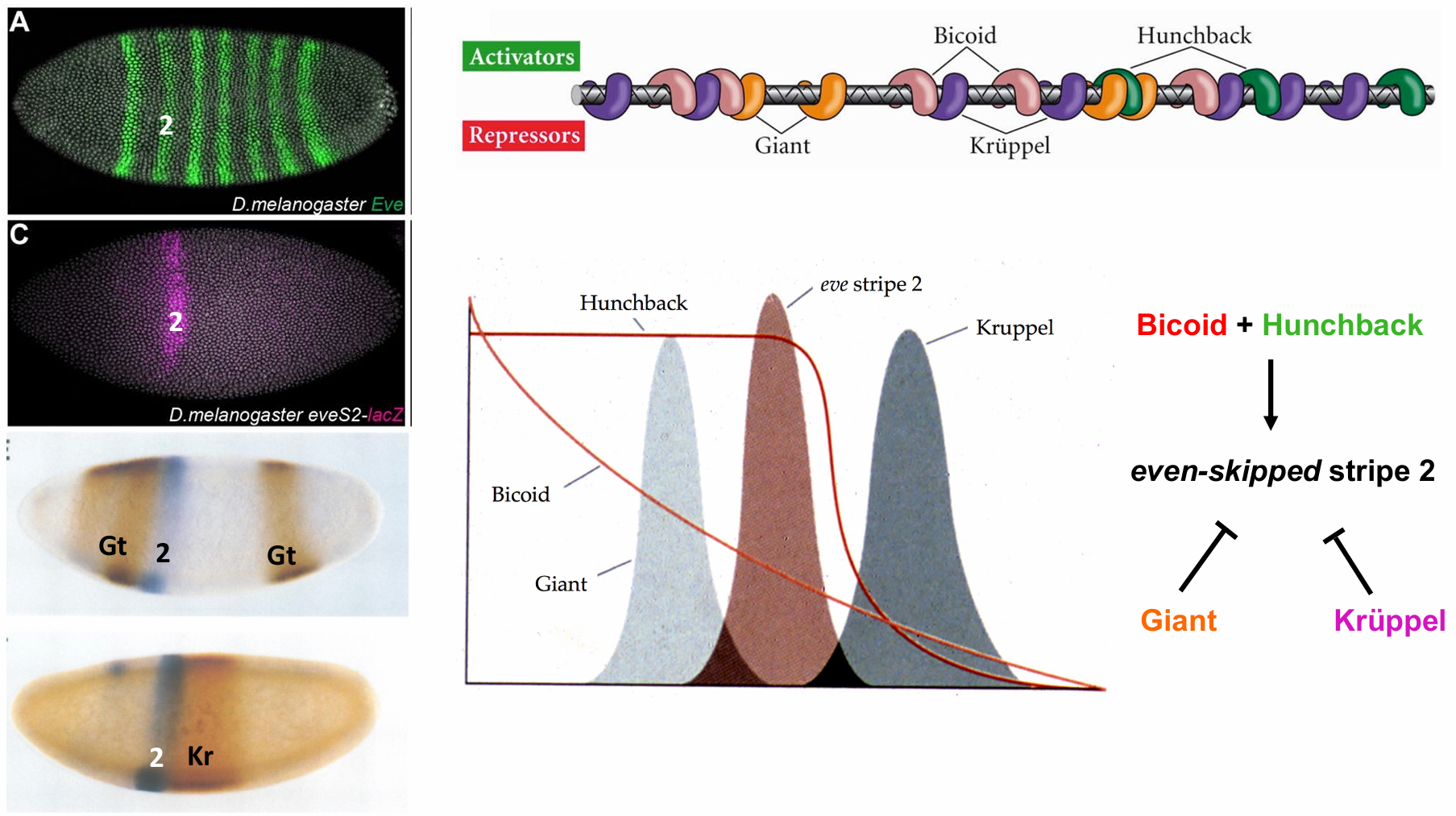
even-skipped基因的调控机制
一旦被裂隙基因的蛋白质所启动,初级成对规则基因的转录图式通过它们的基因产物之间的相互作 用而变得稳定。初级成对规则基因也能形成一个环境,允许或者抑制发挥后期作用的次级成对规则基因的表达,如fushi tarazu(图9.21)。所有8个已知的成对规则基因都以条带图式表达,但这些图式又互不重合。相反,副体节中的每一列细胞核都独具一组成对规则基因的产物,使之 有别于任何其他列的细胞核。这些产物激活下一层次的分节基因,即体节极性基因。
体节极性基因(Segment polarity genes)
体节极性基因的表达
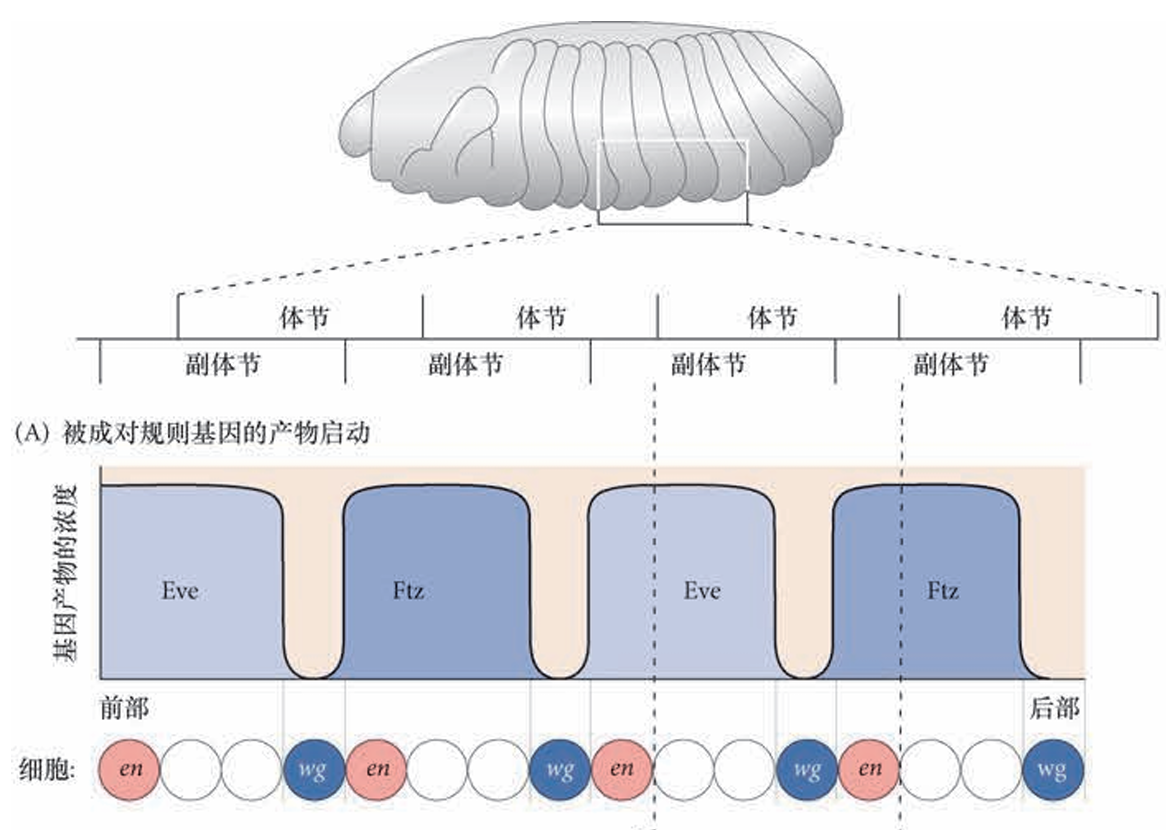
体节极性基因由配对规则基因激活,在 14 个条带中表达,每个副体节PS对应一个条带,其编码编码的蛋白质是Wnt和Hedgehog信号途径的成员,以分泌蛋白的形式发挥作用,在细胞化胚胎中通过细胞间信号传递发挥作用,而非转录因子。体节极性基因的突变导致分节缺陷和每个副体节中基因表达图式的改变。
正常图式的发育需要每个副体节中仅有一列细胞能表达Hedgehog 蛋白,也仅有一列细胞能表达Wingless蛋白(Wg蛋白是果蝇中的Wnt蛋白)。这一图式形成的关键是在表达Hedgehog的细胞中激活engrailed(en)基因。engrailed在Even-skipped、Fushi tarazu 或者Paired 转录因子表达水平高的细胞中被激活,但在Odd-skipped、Runt或Sloppy-paired蛋白表达水平高的细胞中受到抑制。因此,Engrailed蛋白沿胚胎的前-后轴方向在14个条带中表达(见图9.7E)。在缺失ftz的胚胎中,engrailed仅在7个条带中表达. 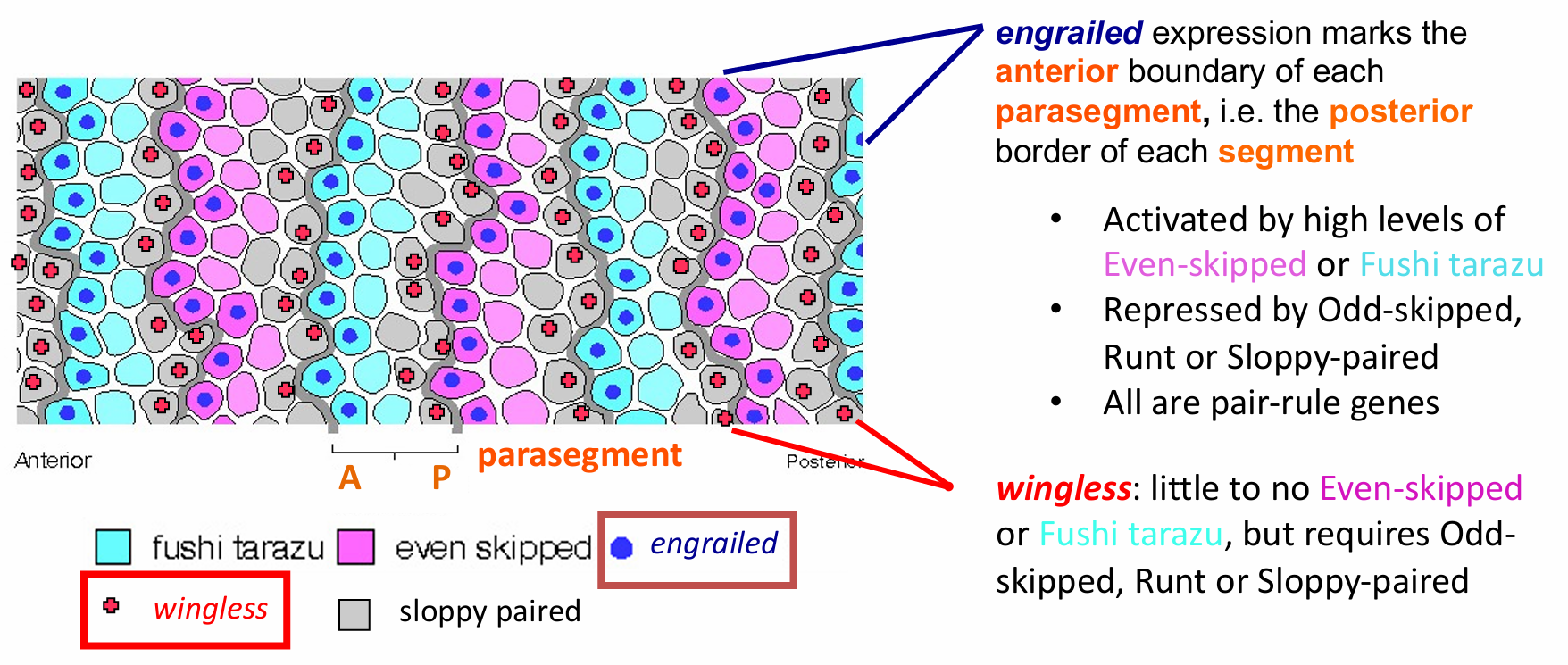
wg蛋白和en蛋白表达的示意图。两种蛋白确立了副体节的边界
那些engrailed 的转录条带标志每个副体节的前部区室(以及每个体节的后部区室)。在极少或者没有Even-skipped 或 Fushi tarazu 蛋白,但有Sloppy-paired 蛋白的细胞条带中,wingless(wg) 基因被激活。 这一图式使得wingless只能在紧邻engrailed转录条带前部的那一纵列细胞中表达(图9.22A)。
wg蛋白和en蛋白表达的示意图。
表达图式的维持
一旦wingless 和 engrailed 在相邻细胞中的表达图式得以建立,这些图式还必须予以维持,而参与建立图式的一些mRNA和蛋白质的寿命很短,难以长久表达从而保持躯体图式中副体节的周期性。
wg和en的持续表达由表达Engrailed和表达Wingless 的细胞之间的相互作用来维持。Wingless蛋白被分泌后扩散到周围的细胞。在具有 Engrailed 表达能力的细胞中(也就是具有Eve或者Ftz蛋白), Wingless 被 Frizzled 和 Lrp6 受体蛋白结合,通过Wnt信号途径激活en基因。Armadillo 是 果蝇中的β- 联蛋白。Engrailed蛋白激活hedgehog 基因的转录,也激活自身(en)的转录。Hedgehog蛋白 从这些细胞中扩散出来,与相邻细胞上的Patched受体蛋白结合。 Hedgehog 信号使wg基因转录和随后的Wingless 蛋白分泌。
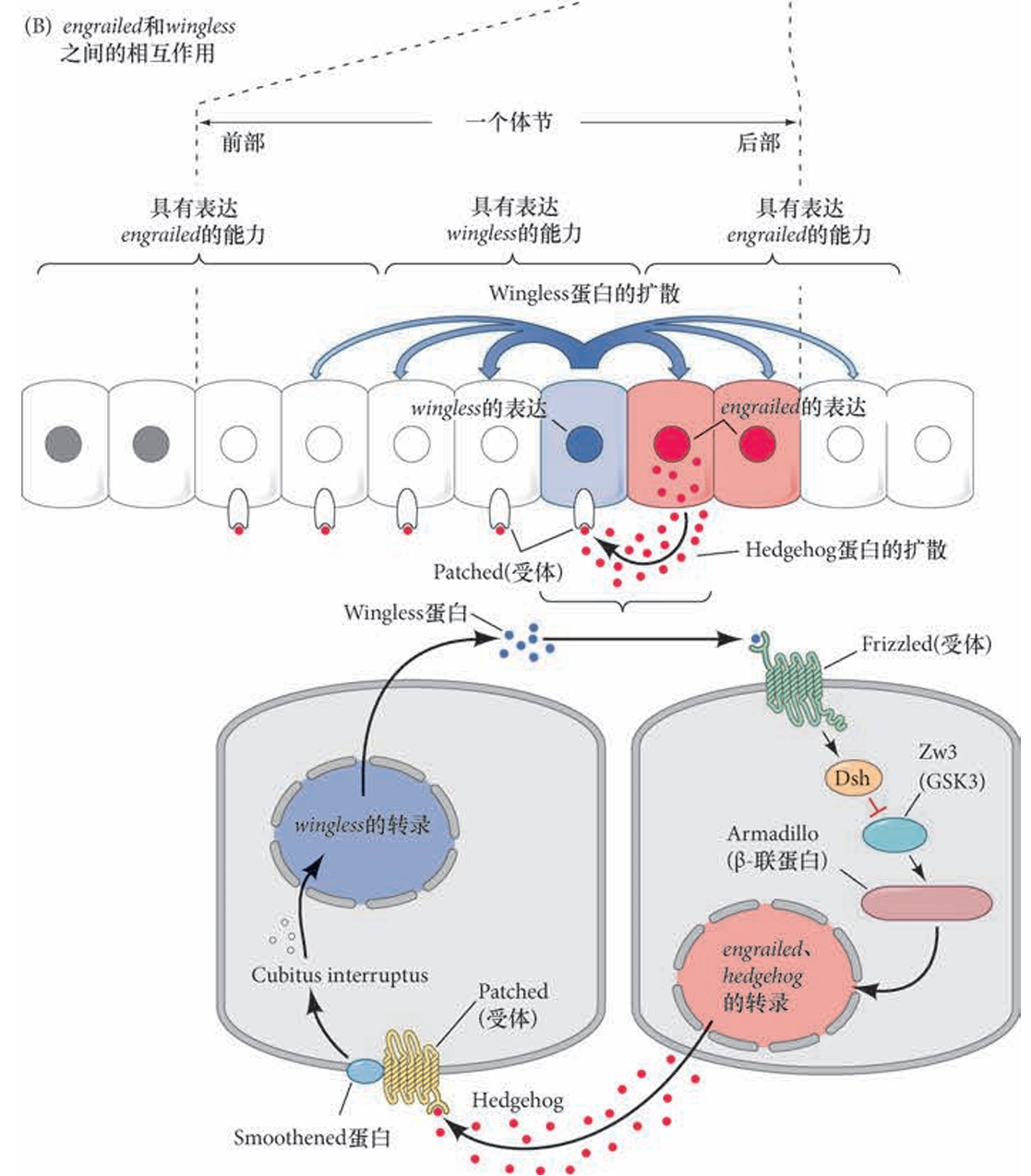
表达图式的维持示意图。
同源异形基因
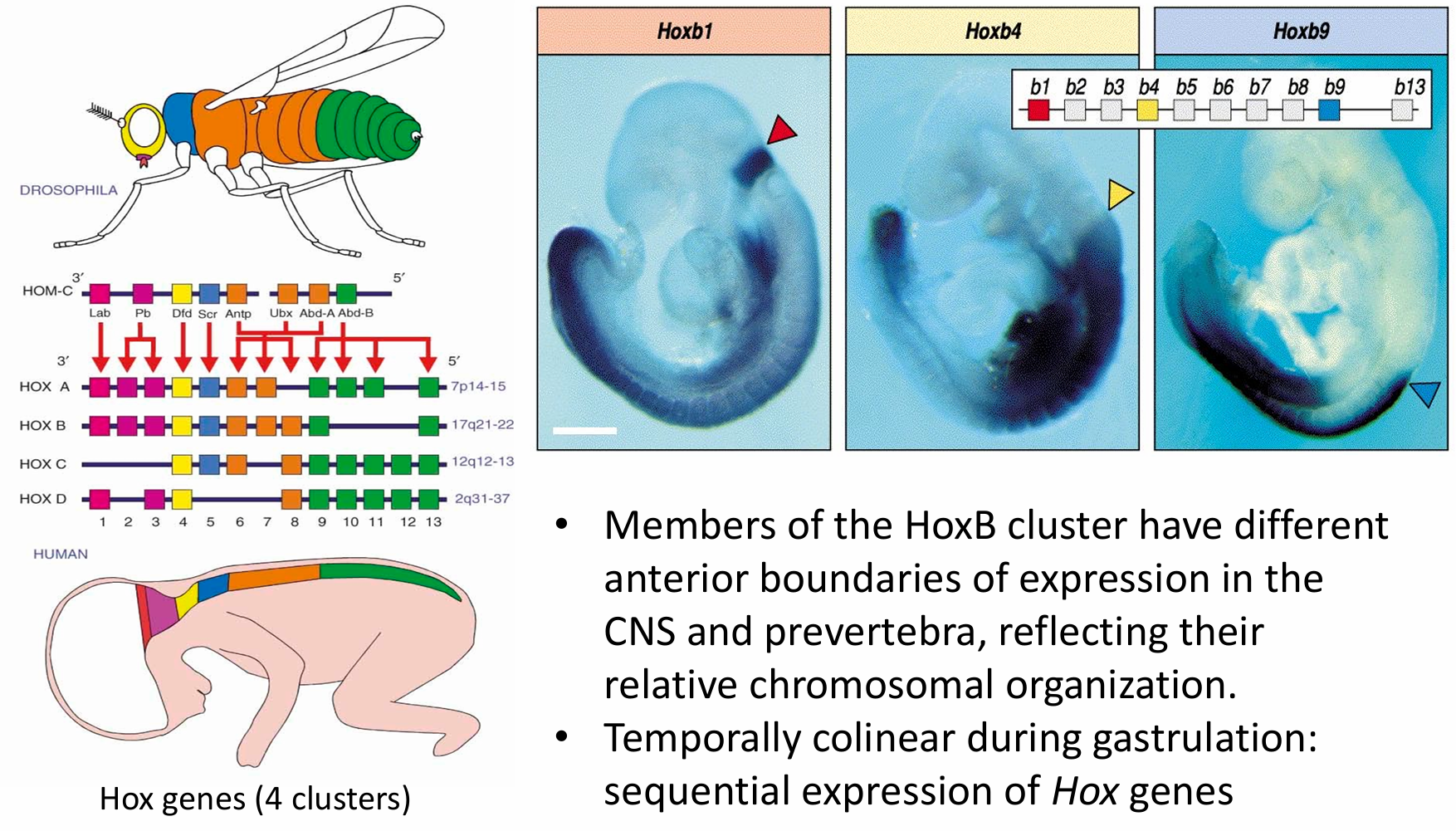
体节的边界建立以后,成对规则基因和裂隙基因之间相互作用,调节一些赋予每个体节特征性结 构的同源异形选择者基因(Lewis 1978)。在细胞胚盘期结束时,每个体节原基已经被一组特定的裂隙基 因、成对规则基因和同源异形基因的产物赋予了一个独立的特征(Levine and Harding 1989)。果蝇染色体 III 的两个区域含有大多数这些同源异形基因(图9.24)。第一个区域,称为触角足复合物(Antennapedia complex),含有唇(lab)、触角足(Antp)、性梳减少(scr)、畸形(dfd)及口器足(pb)基因。唇和畸形基 因特化头节,而性梳减少和触足基因参与特化胸节的特征。口器足基因似乎仅在成体中发挥功能,缺失 这个基因时口的唇瓣转变成腿(Wakimoto et al. 1984;Kaufman et al. 1990;Maeda and Karch 2009)。
第二个区域的同源异形基因(Lewis 1978;Maeda and Karch 2009)是双胸复合物(bithorax complex)。 这一区域有三个编码蛋白质的基因:超级双胸(Ultrabithorax,Ubx)基因为第三胸节的特化所需; abdominal A(abdA) 和 Abdominal B(AbdB) 基因调控腹节的分节特征(Sánchez-Herrero et al. 1985)。含有触角足复合物和双胸复合物的染色体区域常被称为同源异形复合体(homeotic complex,或HOM-C)。
由于同源异形选择者基因调控果蝇不同部分的特化,因此,它们的突变导致一些古怪的表型。在 1894 年,William Bateson 将这些突变生物体称为同源异形突变体(homeotic mutant),数十年来,这些突 变体一直令发育生物学家们着迷。例如,正常成体果蝇的躯体有三个胸节,每一节上都产生一对腿。第 一胸节不产生任何其他附肢;第二胸节除了有腿之外还产生一对翅;第三胸节产生一对腿和一对称为平 衡棒(haltere) 的平衡器官。在同源异形突变体中,每个体节的特定特征都会发生改变。缺失超级双胸基 因时,第三胸节(以平衡棒为特征)转变成另一个第二胸节。结果是果蝇具有四个翅(图9.25),使经典 双翅昆虫8处在一种尴尬的情形。
类似地,触角足蛋白通常特化果蝇的第二胸节。如果果蝇发生突变,导致触角足基因在头部(及胸 部)表达,那么从头窝中生长出来的结构将是腿而不是触角(图9.26)。除了促进胸部结构的形成以外,导致这一表型的部分原因是触角足蛋白结合并抑制homothorax和eyeless基因的增强子。这两个基因编码 的转录因子对于触角和眼的形成有关键的作用(Casares and Mann 1998;Plaza et al. 2001)。因此,触角足 蛋白的一个功能是抑制启动触角和眼发育的基因。在触角足的隐性突变体中,这个基因无法在第二胸节 表达,这样就在腿的位置长出了触角(Struhl 1981;Frischer et al. 1986;Schneuwly et al. 1987)。
一些主要的同源异形选择者基因已经被克隆出来,而且利用原位杂交的方法对它们的表达进行了 分析(Harding et al. 1985;Akam 1987)。在胚胎的一些特定区域都能检测到这些基因的转录产物(见 图9.24B),在中枢神经系统中尤为显著。
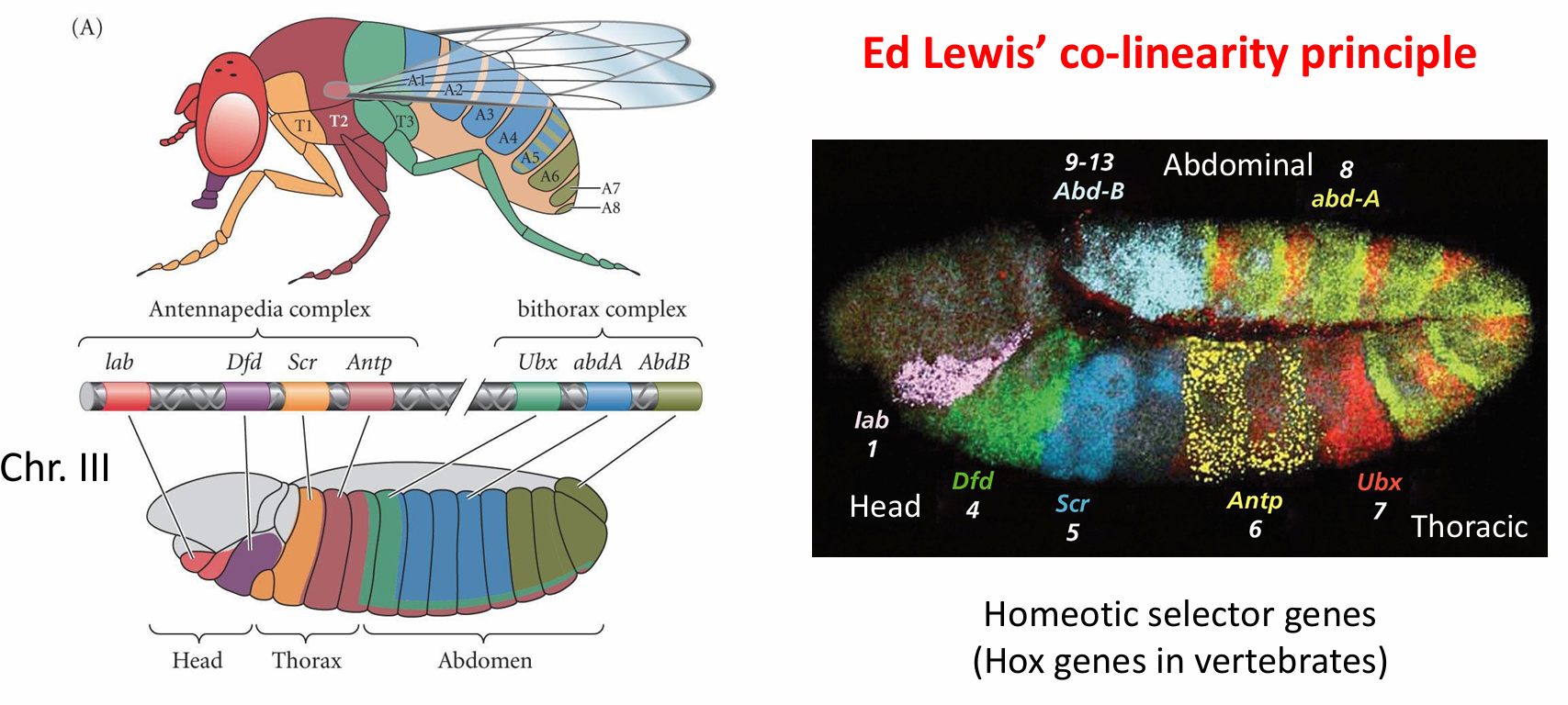
Hox genes 的演化
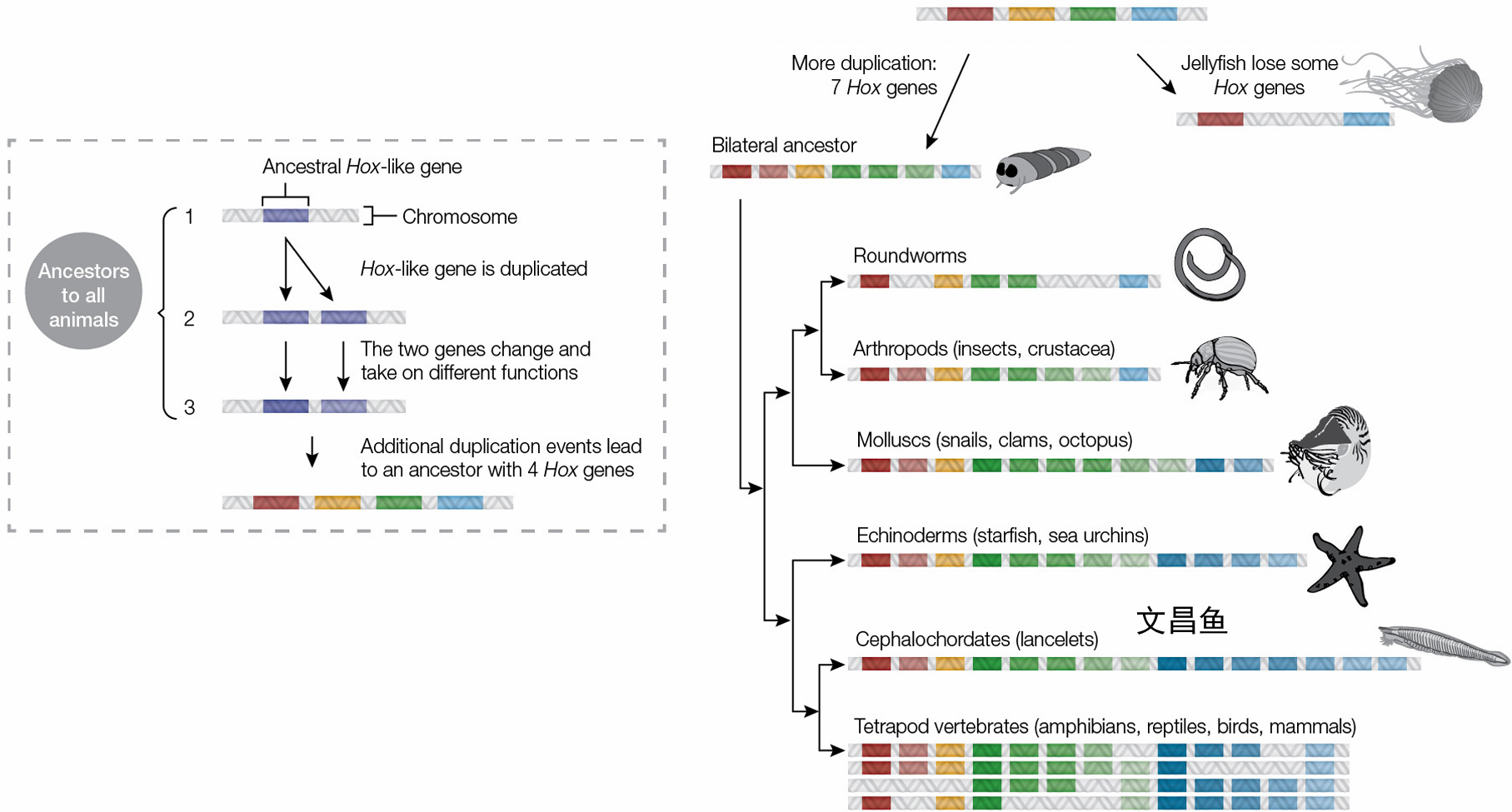
哺乳动物同源异形基因成簇分布